1、实验题 (10分)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号
| 反应物
| 催化剂
|
①
| 10mL2% H2O2溶液
| 无
|
②
| 10mL5% H2O2溶液
| 无
|
③
| 10mL5% H2O2溶液
| 1mL0.1mol·L-1FeCl3溶液
|
④
| 10mL5% H2O2溶液+少量HCl溶液
| 1mL0.1mol·L-1FeCl3溶液
|
⑤
| 10mL5% H2O2溶液+少量NaOH溶液
| 1mL0.1mol·L-1FeCl3溶液
|
(1)催化剂能加快化学反应速率的原因是_____________________________________。
(2)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________。
(3)写出实验③的化学反应方程式 。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。


分析上图能够得出的实验结论是______________________________________。
参考答案:(1)降低了活化能(2分)?
(2)探究浓度对反应速率的影响 (2分)
向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(2分)
(3)2H2O2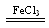 O2↑+2H2O(2分)
O2↑+2H2O(2分)
(4)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率 (2分)
本题解析:(1)催化剂能加快反应速率的原因是能降低反应的活化能。(2)实验①和②,不同的是浓度,所以探究的是浓度对反应速率的影响。由于长时间没有观察到明星现象,说明反应速率很小,可以使用同种同量的催化剂,或同时加热,即将试管放入同一热水浴中。(3)③是过氧化氢在氯化铁做催化剂条件下的反应,故反应写成:2H2O2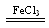 O2↑+2H2O。(4)三个反应中,⑤速率最快,④最慢,说明反应在碱性环境中能增大反应速率,酸性环境能减慢反应速率。
O2↑+2H2O。(4)三个反应中,⑤速率最快,④最慢,说明反应在碱性环境中能增大反应速率,酸性环境能减慢反应速率。
考点:反应速率的影响因素。
本题难度:困难
2、选择题 一般都能使反应速率加快的方法是( )
①升温;②改变生成物浓度;③增加反应物浓度;④加压.
A.①②③
B.①③
C.②③
D.①②③④
参考答案:①升高温度,增加单位体积内的活化分子数,有效碰撞增加,反应速率加快,故①正确;
②改变生成物浓度,不一定影响反应物的浓度的增大,反应速率不一定增大,故②错误;
③增加反应物浓度,单位体积内活化分子增大,有效碰撞增加,反应速率加快,故③错误;
④增大压强对有气体参加的反应,反应速率加快,若没有气体参加,压强对反应速率不影响,故④错误;
故选B.
本题解析:
本题难度:简单
3、选择题 NO和NO2都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮和二氧化碳气,2NO+2CO=N2+2CO2,对此反应,下列叙述正确的是(双选)……( )
A.使用催化剂能加快反应速率
B.改变压强对反应速率没有影响
C.冬天气温低,对人危害更大
D.外界任何条件怎样改变,均对此化学反应速率无影响
参考答案:AC
本题解析:这是一个气体物质间的化学反应,改变反应物的浓度、压强、温度均能改变该反应的速率。所以D错误。
增大压强,可以使气体物质的体积变小,其浓度变大,所以反应速率加快,反之,减小压强,可使气体的体积变大,浓度变小,反应速率变慢,由于该反应是气体物之间的反应,改变压强,对反应速率有影响,故B也错误。
升高温度,可以加快反应速率,降低温度可减慢反应速率。由于NO和CO对人的危害远大于N2和CO2,所以当NO与CO反应生成N2和CO2的速率降低时,对人危害更大。故C正确。
催化剂可以改变化学反应速率,我们通常所说的催化剂一般都指正催化剂,能加快反应速率,故A正确。
本题难度:一般
4、选择题 一定量的盐酸与过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的? (? )
A.NaOH(s)
B.KNO3 (s)
C.NaCl 水溶液
D.NaHSO4(s)
参考答案:C
本题解析:略
本题难度:简单
5、选择题 下列有关化学反应现象和化学原理的解释正确的是
[? ]
现象或反应
原理解释
A.
KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去
SO2具有漂白性
B.
合成氨反应需在高温条件下进行
该反应为吸热反应
C.
蒸馏时,温度计的水银球应靠近蒸馏烧瓶支管口处
在此位置指示被蒸馏
物质的沸点才更加准确
D.
SO2=S+O2在任何条件下均不能自发进行
该反应△H>0,△S>0
参考答案:D
本题解析:
本题难度:一般