1、选择题 已知250C、101KPa下:①C(s)+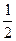 O2(g)="CO(g)?" △H=
O2(g)="CO(g)?" △H= 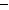 Q1kJ/mol?②2 CO(g)+ O2(g)=2CO2(g)?△H=
Q1kJ/mol?②2 CO(g)+ O2(g)=2CO2(g)?△H=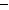 Q2kJ/mol (Q1、Q2均为正数)据此推断,下列说法正确的是
Q2kJ/mol (Q1、Q2均为正数)据此推断,下列说法正确的是
A.碳的燃烧热为Q1kJ/mol
B.2molCO(g)所具有的能量一定高于2molCO2(g)所具有的能量
C.一定质量的碳燃烧,生成CO2(g)比生成 CO(g)时放出的热量多
D.碳燃烧生成CO2气体的热化学方程式为:C(s)+ O2(g)=CO2(g) △H= 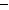 (Q1+Q2)kJ/mol
(Q1+Q2)kJ/mol
参考答案:
C
本题解析:
A项,燃烧热是指1mol物质完全燃烧,生成稳定的化合物,所放出的热量。由于C(s)+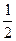 O2(g)="CO(g)?" △H=
O2(g)="CO(g)?" △H= 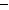 Q1kJ/mol,生成的是CO,不是稳定的化合物,所以Q1kJ/mol不是碳的燃烧热;B项,反应②属于放热反应,只能说2molCO(g)和1molO2(g)所具有的能量一定高于2molCO2(g)所具有的能量;C项,生成CO2(g)是完全燃烧,而生成 CO(g)则是不完全燃烧,所以前者放出的热量多;D项,△H=
Q1kJ/mol,生成的是CO,不是稳定的化合物,所以Q1kJ/mol不是碳的燃烧热;B项,反应②属于放热反应,只能说2molCO(g)和1molO2(g)所具有的能量一定高于2molCO2(g)所具有的能量;C项,生成CO2(g)是完全燃烧,而生成 CO(g)则是不完全燃烧,所以前者放出的热量多;D项,△H= 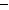 (2Q1+Q2)kJ/mol
(2Q1+Q2)kJ/mol
本题难度:一般
2、选择题 据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是? ( )。
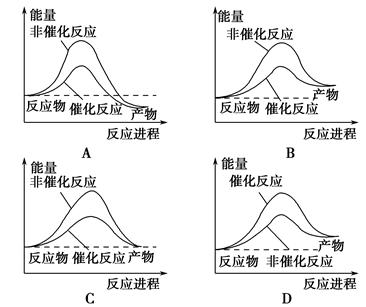
参考答案:B
本题解析:B选项正确,水分解反应是吸热反应,反应后能量变大,催化剂可以降低反应的活化能,但不能改变反应的热效应。
本题难度:一般
3、选择题 下列反应中属于放热反应的是()
①.碳酸钙受热分解②乙醇燃烧③铝粉与氧化铁粉末反应④氢氧化钠溶于水
⑤锌与盐酸反应⑥碳与二氧化碳反应
A.②③④⑤⑥
B.①②③④⑤
C.②③④⑤
D.②③⑤
参考答案:D
本题解析:考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应,所以答案选D。
本题难度:简单
4、选择题 已知:2SO2(g)+O2(g) 2SO3(g)? ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是 ?
2SO3(g)? ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是 ?
A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量
B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ
C.增大压强或升高温度,该平衡都向逆反应方向移动
D.将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ此时有2 mol SO2(g)被氧化
参考答案:D
本题解析:2SO2(g)+O2(g) 2SO3(g)? ΔH=-Q kJ·mol-1 (Q>0),该反应为放热反应,所以相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量大于2 mol SO3(g)所具有的能量,故A错误;该反应为可逆反应,所以将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量小于Q kJ,故B错误;该反应为放热反应,所以该平衡向逆反应方向移动,但是增大压强,反应向正方向移动,故C错误;将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ,此时有2 mol SO2(g)被氧化,故D正确。
2SO3(g)? ΔH=-Q kJ·mol-1 (Q>0),该反应为放热反应,所以相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量大于2 mol SO3(g)所具有的能量,故A错误;该反应为可逆反应,所以将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量小于Q kJ,故B错误;该反应为放热反应,所以该平衡向逆反应方向移动,但是增大压强,反应向正方向移动,故C错误;将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ,此时有2 mol SO2(g)被氧化,故D正确。
点评:本题考查了可逆反应、化学反应中能量的变化,属于对基础知识的考查,该题要理解好可逆反应是不能百分之百进行的。
本题难度:一般
5、填空题 (13分)一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图表示该反应进行过程中的能量变化。
CH3OH(g)+H2O(g),下图表示该反应进行过程中的能量变化。

(1)图中曲线??(填“a”或“b”)表示使用催化剂时的反应进程。使用催化剂对该反应的影响是______(填选项字母)。
A.提高反应速率
B.提高CO2的转化率
C.降低反应活化能
D.改变反应的ΔH
 CH3OH(g)+H2O(g)的化学平衡常数的表达式K=_________。升高温度,K值将_______(填“增大”、“减小”或“不变”)。
CH3OH(g)+H2O(g)的化学平衡常数的表达式K=_________。升高温度,K值将_______(填“增大”、“减小”或“不变”)。 CH3OH(g)+H2O(g)的ΔH="_____" kJ·mol-1
CH3OH(g)+H2O(g)的ΔH="_____" kJ·mol-1