1、填空题 在一定温度下,有A.盐酸? b.硫酸? C.醋酸三种酸:
(1)当其物质的量浓度相同时,C(H+)由大到小的顺序是___________________________;
(2)同体积、同物质的量浓度的三种酸,中和NAOH的能力由大到小的顺序是___________;
(3)若三者C(H+)相同时,物质的量浓度由大到小的顺序是_________________________;
(4)当三者C(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是_____________________________;
(5)当C(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________________,反应所需时间的长短关系是_________________________________;
(6)将C(H+)相同的三种酸均加水稀释至原来的100倍后,C(H+)由大到小的顺序是__
______________________________________________。
参考答案:(1)b>a>c? (2)b>a="c?" (3)c>a>b? (4)c>a="b?" (5)a="b=c?" a=b>c? (6)c>a=b
本题解析:盐酸、硫酸、醋酸三种酸在溶液中的电离情况如下:
盐酸是一元强酸,在水溶液中完全电离,不存在电离平衡:HCl====H++Cl-。
硫酸是二元强酸,在水溶液中也完全电离,不存在电离平衡:H2SO4====2H++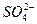 。
。
醋酸是一元弱酸,在水溶液中部分电离,存在电离平衡:CH3COOH CH3COO-+H+。
CH3COO-+H+。
溶液中的c(H+)和c(CH3COO-)较小,其他条件不变,若使c(H+)减小,则电离平衡向正方向进行。
(1)设三种酸的物质的量浓度均为x,则盐酸中c(H+)=c(Cl-)=x,硫酸中c(H+)=2×c(H2SO4)=2x,醋酸中c(H+)<<c(CH3COOH),c(H+)<<x。故b>a>c。
(2)“中和NaOH的能力”是被一定物质的量的酸中和的NaOH的物质的量。由于三种酸溶液的体积相同,物质的量浓度相同,所以三种酸的物质的量相同。由于1 mol H2SO4中和2 mol NaOH、1 mol HCl或1 mol CH3COOH中和1 mol NaOH,故b>a=c。
(3)由(1)分析可知,c(H+)相同时,c(CH3COOH)最大,c(HCl)次之,c(H2SO4)最小,故c>a>b。
(4)当锌足量时,生成H2体积的大小,决定于可被还原的H+总物质的量(包括已电离出的和未电离的)。由于三种酸的c(H+)相同,体积相同,HCl、H2SO4都是强电解质,在溶液中完全电离,所以H+的总物质的量相同,故产生H2体积相同。而CH3COOH是弱电解质,在溶液中存在电离平衡:CH3COOH H++CH3COO-。当c(H+)减小时,CH3COOH的电离平衡向右移动,使H+不断产生。反应产生的H2体积变大。故c>a=b。
H++CH3COO-。当c(H+)减小时,CH3COOH的电离平衡向右移动,使H+不断产生。反应产生的H2体积变大。故c>a=b。
(5)由于开始时,三者c(H+)相同,且锌的形状、密度、质量也相同,由影响化学反应速率的因素以及规律可知,反应开始时三者速率相同。随着反应的不断进行,HCl、H2SO4中的H+不断减少,故反应越来越慢,而CH3COOH随着反应的进行,又不断电离出H+,则相应c(H+)较大,反应速率较快,生成相同体积的H2时,时间最短,故开始时速率都相同,所需时间a=b>c。
(6)由于HCl、H2SO4完全电离,加水稀释100倍,H+的数目不变,c(H+)溶液变为原来的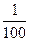 ,CH3COOH部分电离,随着水的加入,使CH3COOH的电离程度增大,c(H+)减小的程度较小,故c>a=b。
,CH3COOH部分电离,随着水的加入,使CH3COOH的电离程度增大,c(H+)减小的程度较小,故c>a=b。
本题难度:简单
2、选择题 已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
[? ]
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
参考答案:B
本题解析:
本题难度:一般
3、选择题 电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100 mol·L-1 NH3·H2O溶液滴定10.00 mL浓度均为0.100 mol·L-1盐酸和CH3COOH溶液的混合溶液,所得曲线如图所示。下列说法正确的是( )
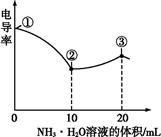
A.①点溶液中c(H+)为0.200 mol·L-1
B.溶液温度高低为①>③>②
C.③点溶液中有c(Cl-)>c(CH3COO-)
D.③点后因离子数目减少使溶液电导率略降低
参考答案:C
本题解析:①点尚未开始滴定,由于CH3COOH是弱酸,存在电离平衡,此时c(H+)<0.200 mol·L-1,A选项错;由于中和反应为放热反应,随着反应进行溶液温度升高,B选项错;③点时加入20 mL NH3·H2O 溶液恰好把HCl、CH3COOH完全中和,生成等物质的量的NH4Cl与CH3COONH4,由于CH3COO-发生水解,导致其浓度降低,c(Cl-)>c(CH3COO-),C选项正确;③点后,继续滴加氨水,中和反应已进行完全,溶液体积增大造成离子浓度降低,电导率下降,D选项错。
本题难度:一般
4、选择题 已知25℃时,电离常数Ka(HF)=3.6×10-4 ,溶度积常数Ksp(CaF2) =1. 46×10 -10。现向1L 0.2mol·L-1 HF溶液中加入1L0.2mol·L-1 CaCl2溶液,则下列说法中正确的是
[? ]
A.25℃时,0.1mol·L-1HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生
D.该体系中,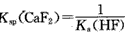
参考答案:C
本题解析:
本题难度:一般
5、选择题 在25℃时,分别用pH=9、pH=10的两种氨水中和同浓度、同体积的盐酸,消耗氨水的体积分别为V1和V2,则V1和V2的关系是( )
A.V1=10V2
B.V1>10V2
C.V1<10V2
D.V2>10V1
参考答案:pH=9的氨水中c(OH-)=10-5 mol/L,pH=10的溶液中c(OH-)=10-4 mol/L,根据题意知,C1(NH3.H2O)V1=C2(NH3.H2O)V2,弱电解质溶液中,溶液浓度越大弱电解质电离程度越小,所以V1V2=c2c1>10,
所以得V1>10V2,故选B.
本题解析:
本题难度:简单