1、实验题 (8分)某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2。该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2,该同学推测反应中可能生成了H2O2,并进行实验探究。
(1)写出Na2O2与水反应的化学方程式?。
(2)试设计实验证明溶液X中含过氧化氢?。
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:?H2O2 +?Fe2+ +?OH-— ?Fe(OH)3?,该反应中H2O2表现了?性(填“氧化”或“还原”)。
(4)已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现了?性(填“氧化”或“还原”)。
参考答案:(8分)
(1)2 Na2O2 + 2 H2O = 4 NaOH + O2↑(2分)
(2)取溶液X少量于洁净的试管中,加入适量MnO2粉末,用带火星的木条检验,若木条复燃证明有H2O2(2分)
(3)1、2、4、2(2分);氧化性(1分)
(4)还原性(1分)
本题解析:Na2O2与水反应的化学方程式是2 Na2O2 + 2 H2O = 4 NaOH + O2↑;证明溶液X中含过氧化氢的方法是:取溶液X少量于洁净的试管中,加入适量MnO2粉末,用带火星的木条检验,若木条复燃证明有H2O2;通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:1H2O2 +2Fe2+ +?4OH-=2?Fe(OH)3?,该反应中H2O2表现了氧化性;已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现还原性。2O2与水的反应
点评:有关Na2O2与水的反应的知识来自于教材,此题要结合实验的目的,注意分析实验过程。
本题难度:一般
2、选择题 只用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区别分开,这种试剂是( )
A.BaCl2溶液
B.FeCl2溶液
C.FeCl3溶液
D.AlCl3溶液
参考答案:A.加入BaCl2溶液不能检验AgNO3和H2SO4,二者都生成沉淀,故A错误;
B.加入FeCl2溶液,不能检验KSCN和稀H2SO4,二者都无现象,故B错误;
C.加入FeCl3溶液,FeCl3溶液生成白色沉淀,KSCN溶液变为红色,稀H2SO4无现象,NaOH溶液生成红褐色沉淀,可鉴别,故C正确;
D.加入AlCl3溶液,不能检验,检验KSCN和稀H2SO4,二者都无现象,故D错误.
故选C.
本题解析:
本题难度:简单
3、实验题
为了探究草酸(H2C2O4)的化学性质,设计如下3个实验:
实验1:取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)
(1)该实验说明草酸具有________(填“氧化”或“还原”)性,该反应的反应速率先慢后快的主要原因可能是__________________。
实验2:取少量草酸晶体装入试管,加水溶解,向试管里滴加足量的澄清石灰水,有白色沉淀生成。
(2)该实验说明草酸具有______性。写出反应的化学方程式:__________________。
实验3:草酸在常温下呈无色晶体状,其晶体的熔化温度低于草酸的分解温度,且易升华。为了探究草酸的不稳定性,某同学设计如下实验装置
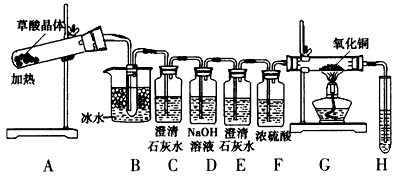
(3)B装置的作用是__________________。C装置变浑浊,E处无现象,G玻璃管里黑色变红色,写出A中反应的化学方程式:__________________。
(4)为了检验G中反应的氧化产物,H试管所装试剂是___________,从环境保护角度来看,该方案的不足之处是________________________。
参考答案:
(1)还原;锰离子起催化作用或锰离子浓度增加,加快了反应速率
(2)酸;Ca(OH)2+H2C2O4=CaC2O4↓+2H2O
(3)冷凝草酸蒸气,避免对二氧化碳的检验产生干扰;H2C2O4 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O
(4)澄清石灰水(或偏铝酸钠溶液或硅酸钠溶液等);没有尾气处理装置
本题解析:
本题难度:一般
4、简答题 溴苯是一种化工原料,实验室合成溴苯的装置示意图如图及有关数据如下:按下列合成步骤回答问题:
| 苯 | 溴 | 溴苯
密度/g-cm-3
0.88
3.10
1.50
沸点/°C
80
59
156
水中溶解度
微溶
微溶
微溶
|
(1)在a中加入15mL无水苯和少量铁屑.
在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了______气体.继续滴加至液溴滴完.装置d的作用是______;制取溴苯的化学方程式______.该反应的催化剂为______.
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是:______.
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母);
A.重结晶?B.过滤?C.蒸馏?D.萃取
(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母).
A.25mL?B.50mL?C.250mL?D.500mL
(5)取反应后烧杯中的溶液2ml加入足量的稀硝酸酸化,再滴入AgNO3溶液,有浅黄色沉淀生成,______(能或不能)证明苯与液溴反生了取代反应,为什么?______.
参考答案:(1)铁和溴反应生成三溴化铁,三溴化铁与苯作用,生成溴苯,同时有溴化氢生成,2Fe+3Br2=2FeBr3,C6H6+Br2FeBr3
本题解析:
本题难度:一般
5、实验题 已知2NO2(g) N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。请回答下列有关问题
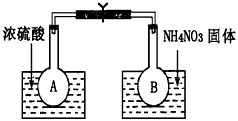
(1)观察到的实验现象为:_____________________________
(2)由实验现象可知,升高温度,该化学平衡向___________(填“正”或“逆”)反应方向移动,反应中NO2的转化率将_______________(填“增大”、“减小”或“不变”)。
Ⅱ. 在三支容积均为30mL针筒中分别抽入10mLNO2气体,将针筒前端封闭。实验过程中第一支针筒不做任何操作,仅作为实验现象观察时的参照对象。
(3)某同学将第二支针筒活塞迅速推至5mL处,此时气体的颜色变深,一段时间后气体颜色又变浅了。试解释一段时间后气体颜色又变浅的原因:________________________。
(4)某同学将第三支针筒活塞迅速拉至20mL处。
① 该同学观察到的现象是:__________________________
② 在此过程中,该反应的化学平衡常数将______________(填“增大”、“减小”或“不变”)。
参考答案:(1)A瓶中气体颜色加深,B瓶中气体颜色变浅
(2)逆;减小
(3)增大压强,平衡向正反应方向移动,NO2浓度减小
(4)①气体的颜色先变浅,一段时间后又变深,但仍比第一支针筒气体的颜色浅;②不变
本题解析:
本题难度:一般