1、选择题 在373K时,密闭容器中冲入一定物质的量的NO2和SO2,发生如下反应:
NO2+SO2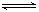 ?NO+SO3,当反应达平衡时,下列叙述正确的时:
?NO+SO3,当反应达平衡时,下列叙述正确的时:
A? NO和SO3的物质的量一定相等
B? NO2和SO2的物质的量一定相等
C?平衡体系中总物质的量一定等于反应开始时总物质的量
D? SO2、NO2、NO、SO3的物质的量一定相等
参考答案:C
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时,各种物质的浓度和含量不再随时间变化而变化,把这种状态称作平衡状态,因此A、B、D不一定正确。因为反应前后气体体积不变,所以平衡体系中总物质的量一定等于反应开始时总物质的量,即选项C是正确的。答案选C。
本题难度:一般
2、选择题 某温度下的恒容密闭容器中发生如下反应:2X(g)+Y(g)? 2Z(g)开始时只充入2.0molX和1.0molY的混合气体,达到平衡时,混合气体的压强比开始时减少了20%。若开始只充入2.0molZ的气体,达到平衡时,Z的分解率为(? )
2Z(g)开始时只充入2.0molX和1.0molY的混合气体,达到平衡时,混合气体的压强比开始时减少了20%。若开始只充入2.0molZ的气体,达到平衡时,Z的分解率为(? )
A.20%
B.40%
C.60%
D.80%
参考答案:B
本题解析:根据题意:可推算出反应达到平衡时各组成成分的物质的量。
2X(g) + Y(g) 2Z(g) ?设X的变化量为a
2Z(g) ?设X的变化量为a
起始量:2.0 mol? 1.0 mol
变化量: a?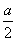 ? a
? a
平衡时:2-a?1-a/2? a?2-a+1-a/2+a=3×(1-20%)
a="1.2" mol
在同温和同一容器中进行逆向反应达平衡时,各组成成分的物质的量与上述反应相同。
2Z? ?2X(g)+Y(g)
?2X(g)+Y(g)
开始时? 2.0 mol ?0? 0
平衡时? 1.2 mol ? 0.4 mol? 0.8 mol
Z的分解率为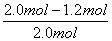 ×100%=40%。答案为B项。
×100%=40%。答案为B项。
本题难度:一般
3、选择题 恒温恒容条件下,下列叙述正确的是
A.相同的甲、乙两容器中分别加入1 g SO2、1 g O2与2 g SO2、2 g O2,发生反应2SO2(g)+O2(g)  SO3(g)达到平衡,SO2的转化率前者大
SO3(g)达到平衡,SO2的转化率前者大
B.反应2HI(g)  H2(g)+I2(g)达到平衡,增大HI的物质的量,平衡不移动
H2(g)+I2(g)达到平衡,增大HI的物质的量,平衡不移动
C.反应2NO2(g )  N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡时,与第一次平衡时相比,NO2的体积分数增大
N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡时,与第一次平衡时相比,NO2的体积分数增大
D.反应2HI(g)  H2(g)+I2(g)达到平衡,增大HI的物质的量,HI的分解率和体积分数均不变
H2(g)+I2(g)达到平衡,增大HI的物质的量,HI的分解率和体积分数均不变
参考答案:D
本题解析:A中后者c(SO2)、c(O2)大,则压强大,所以后者SO2的转化率大;
B中增大HI的物质的量,即增大了c(HI),平衡右移;但压强的增大不影响平衡移动,所以达到的新平衡态与原平衡态相同,故D正确;
C中再向容器内通入一定量的NO2(g),即增大了c(NO2),平衡右移,所以:重新达到平衡时,与第一次平衡时相比,NO2的体积分数减小;
本题难度:一般
4、填空题 向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O2(g)?
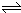
2SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,计算:
(1)以O2表示的该反应的速率______
(2)平衡时SO3的物质的量浓度______.
参考答案:(1)以SO2表示的该反应的速率v(SO2)=(7-3)mol4L4s=0.25mol?L-1?s-1,速率之比等于化学计量数之比,所以有:
v(O2)=12v(SO2)=12×0.25mol?L-1?s-1=0.125mol?L-1?s-1;
故答案为:0.125mol?L-1?s-1
(2)参加反应的SO2的物质的量为7mol-3mol=4mol,根据方程式2SO2(g)+O2(g)?2SO3(g)可知,生成的SO3的物质的量等于参加反应的SO2的物质的量,平衡时SO3的物质的量浓度为c(SO3)=4mol4L=1mol/L.
故答案为:1mol/L
本题解析:
本题难度:一般
5、选择题 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,平衡后测得X,Y的转化率与起始时两物质的物质的量之比nx/ny的关系如图所示,则X,Y的反应方程式可表示为
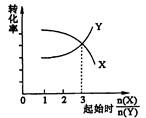
A? 2X+Y 3Z? B? 3X+2Y
3Z? B? 3X+2Y 2Z
2Z
C? X+3Y Z? D? 3X+Y
Z? D? 3X+Y Z
Z
参考答案:D
本题解析:反应物只有按照方程式中的化学计量数充入进行反应,其转化率才是相等的,所以根据图像可判断,X和Y的物质的量之比是3︰1,所以选项D正确。
本题难度:一般