1、选择题 实验室用未知浓度的NaOH溶液滴定20.00mL0.1000 mol·L-1HCl溶液,以测定NaOH溶液的浓度,下列有关判断正确的是 ( )
A.若碱式滴定管未用NaOH溶液润洗,则测定结果偏高
B.装标准盐酸的锥形瓶用标准盐酸润洗会使滴定结果偏高
C.取用标准盐酸的酸式滴定管未润洗会使测定结果偏高
D.滴定前仰视读数,滴定后俯视液面读数会使测定结果偏低
参考答案:C
本题解析:碱式滴定管未用NaOH溶液润洗,则氢氧化钠被稀释,消耗氢氧化钠的体积增加,则测定结果偏低,A不正确。装标准盐酸的锥形瓶用标准盐酸润洗,消耗氢氧化钠的体积增加,则测定结果偏低,B不正确。取用标准盐酸的酸式滴定管未润洗,则消耗氢氧化钠溶液的体积减少,测定结果偏高,C正确。滴定前仰视读数,滴定后俯视液面读数,则耗氢氧化钠溶液的体积减少,测定结果偏高,D不正确。答案选C。
本题难度:一般
2、选择题 下列实验操作不正确的是?
A.做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象
B.进行分液操作时,应将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准上口颈上的小孔,打开旋塞,使下层液体从漏斗颈下慢慢流出,待下层液体完全流出后,关闭旋塞,上层液体从漏斗上口倒出
C.蒸发操作中,边加热边用玻璃棒搅拌,当加热至蒸发皿中有较多固体析出时,应停止加热,利用余热将液体蒸干
D.过滤操作中,滤纸边缘一定低于漏斗边缘,将玻璃棒靠在三层滤纸的边缘,将烧杯嘴靠在玻璃棒上,慢慢引流倒入液体
参考答案:A
本题解析:做“钠与水的反应”实验时,应该先在烧杯中加入水和几滴酚酞试液,最后加入金属钠,观察,选项A不正确,其余选项都是正确的,答案选A。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
3、实验题 (12分)尖晶石型锰酸锂(LiMn2O4)是一种环保绿色能源新型材料。实验室通过下列方法制取:将MnO2和Li2CO3按4︰1的物质的量比配料,球磨3~5小时,然后升温至600℃~750℃,保温24小时,自然冷却至室温得产品。
(1)保温24小时的目的是____________________________________________________。
(2)写出该反应的化学方程式_________________________________________________。
(3)实验室测定锰酸锂中锰的平均化合价的实验步骤如下:
步骤1:准确称取0.1g左右的尖晶石型锰酸锂试样于锥形瓶中,加入5mL稀硫酸、10.00mL 0.2000mol/L草酸钠(Na2C2O4)标准溶液,于80℃水浴加热溶解;
步骤2:待试样全部溶解,立即用浓度为0.2000mol/L的高锰酸钾溶液滴定至终点;
步骤3:计算样品得电子的物质的量n;
步骤4:将溶液中Mn2+氧化为Mn3+,再用硫酸亚铁铵标准溶液滴定,记录实验数据,计算出样品中Mn元素的质量为m;
步骤5:将实验步骤1-4重复2次。
已知反应: 2Mn3++C2O42-=2Mn2++2CO2↑;Mn4++C2O42-=Mn2++2CO2↑
2MnO4-+5C2O42-+16H+="2" Mn2++10 CO2↑+8H2O
①步骤2中,为判断滴定终点,_________(填“需要”或“不需要”)加入指示剂。
②步骤4中,滴定时盛放硫酸亚铁铵标准溶液的玻璃仪器是___________________。
③请用样品得电子的物质的量n和样品中Mn元素的质量m来表示样品中Mn元素的化合价=_____。
参考答案:(1)MnO2与Li2CO3充分反应。
(2)8MnO2 + 2Li2CO3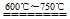 4LiMn2O4 + 2CO2↑ + O2↑。
4LiMn2O4 + 2CO2↑ + O2↑。
(3)①不需要。? ②酸式滴定管。? ③。
本题解析:(1)保温24小时的目的是让MnO2与Li2CO3充分反应。(2)MnO2和Li2CO3反应后只有Mn的价态降低,必然有元素的化合价升高,C元素处在最高价态,不能升高,则只能是O元素价态升高,所以还有O2生成。该反应的方程式为:8MnO2+2Li2CO3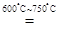 4LiMn2O4 + 2CO2↑ + O2↑。(3)①因为KMnO4本身有颜色,所以不需要指示剂。②硫酸亚铁铵溶液水解呈酸性,所以要用酸式滴定管盛放。③设Mn元素的化合价为x,则n=
4LiMn2O4 + 2CO2↑ + O2↑。(3)①因为KMnO4本身有颜色,所以不需要指示剂。②硫酸亚铁铵溶液水解呈酸性,所以要用酸式滴定管盛放。③设Mn元素的化合价为x,则n=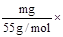 (x-2),x=2 + 55n/m。
(x-2),x=2 + 55n/m。
点评:本题看似复杂,但是问题比较简单,只要掌握基本知识就可以解答。
本题难度:一般
4、选择题 下列有关实验的操作过程,正确的是
[? ]
A.钠与水的反应:用镊子从试剂瓶中取出金属钠,用小刀切下绿豆粒大小的一块钠。小心放入装满水的烧杯中
B.配制100mL的质量分数10%的H2O2溶液:取一支规格为100mL的量筒,先取质量分数为30%的双氧水溶液33.3mL,然后于加水至100mL刻度线
C.检验某浅绿色溶液中含有Fe2+离子:取该溶液少许,向其中加入KSCN溶液,不变红色;再向其中滴加氯水,溶液变为红色。
D.取出分液漏斗中所需的上层液体:当下层液体从分液漏斗下端管口流出后,及时关闭活塞,然后更换一个接收容器,打开活塞将分液漏斗中的液体放出。
参考答案:C
本题解析:
本题难度:一般
5、选择题 现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下:
物质
| 化学式
| 熔点( ℃)
| 沸点( ℃)
| 密度(g·cm-3)
| 水中溶解性
|
甲
| C3H6O2
| -98
| 57.5
| 0.93
| 可溶
|
乙
| C4H8O2
| -84
| 77
| 0.90
| 可溶
|
据此,将甲和乙互相分离的最佳方法是(?)
A.萃取法
B.生化法
C.分馏法
D.分液法
参考答案:C
本题解析:本题要求根据试题给定的甲乙两物质的性质,综合分析后选出分离方案。升华法显然不行;因为甲乙两物质均溶于水,所以能用分液、萃取也不可行;只能根据沸点的差异采取分馏法比较合适。
本题难度:简单