1、简答题 下表为长式周期表的一部分,其中的编号代表对应的元素.
(1)写出上表中元素⑨原子的外围电子排布式______.
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:______杂化,元素⑦与⑧形成的化合物的晶体类型是:______.
(3)元素④的第一电离能______元素⑤(选填“>”、“=”、“<”)的第一电离能;元素④与元素①形成的X分子的空间构型为:______.请写出与N2互为等电子体的分子、离子的化学式______、______(各写一种).
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:______.
(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式是:______.
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,其离子方程式为:______.
参考答案:根据元素周期表结构,可以确定①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩元素分别为:H、Be、C、N、O、F、Mg、
Cl、Cr、Cu,
(1)⑨是Cr元素,Cr是24号元素,其原子核外有24个电子,根据能量最低原理及洪特规则书写其核外电子排布式,3d能级的能量大于4s能级的能量,所以先排4s后排3d,轨道中的电子处于全满、半满、全空时原子最稳定,所以Cr的核外电子排布式为1s22s22p63s23p63d54s1,外围电子排布式3d54s1.
故答案为:3d54s1;
(2)乙烯中有双键和单键,其中碳碳双键中一个是σ键和1个p-p的π键,其余的4个碳氢键均为σ键,碳原子杂化轨道数为3,所以采用sp2杂化方式;
活泼金属与活泼非金属形成离子化合物,元素⑦与⑧形成的化合物是氯化镁,属于离子化合物,形成离子晶体.
故答案为:sp2;离子晶体;
(3))④是N元素,外围电子排布式2s22p3,⑤是O元素,外围电子排布式2s22p4,两元素处于同一周期,氧原子原子序数大,但N元素P能级处于半满,能量更低,原子较稳定,其第一电离能氧原子的第一电离能大;
元素④与元素①形成的是NH3分子,N原子采取sp3杂化,有一对孤对电子对,所以为三角锥形;
?N2有2个原子,14个电子(或10个价电子),其等电子体为CO、C22-?等;
故答案为:>;三角锥形;CO、C22-;?
(4)F的电负性大,HF分子间会形成氢键,实验测得的值一般高于理论值.
故答案为:HF分子间会形成氢键;
(5)Mg与稀硝酸反应方程式为4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O.
故答案为:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O.
(6)过量氨气与硫酸铜溶液反应,生成深蓝色四氨合铜络离子,离子方程式为Cu2++4NH3=[Cu(NH3)4]2+.
故答案为:Cu2++4NH3=[Cu(NH3)4]2+.
本题解析:
本题难度:一般
2、选择题 下列关于物质性质变化的比较,不正确的是( )
A.原子半径大小:Na>S>O
B.气态氢化物稳定性:HBr<HCl<HF
C.碱性强弱:KOH>NaOH>LiOH
D.还原性强弱:F->Cl->Br->I-
参考答案:A.O的电子层数为2,Na、Al的电子层数为3,同周期从左向右原子半径在减小,则原子半径为Na>S>O,故A正确;
B.非金属性F>Cl>Br,气态氢化物的稳定性为HBr<HCl<HF,故B正确;
C.金属性K>Na>Li,对应最高价氧化物的水化物的碱性为KOH>NaOH>LiOH,故C正确;
D.非金属性F>Cl>Br>I,对应离子的还原性为F-<Cl-<Br-<I-,故D错误;
故选D.
本题解析:
本题难度:简单
3、选择题 下列各组中化合物的性质比较,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
C.稳定性:HCl>H2S>PH3
D.还原性:F->Cl->Br-
参考答案:A.非金属性Cl>Br>I,对应元素的最高价氧化物的水化物的酸性为HClO4>HBrO4>HIO4,故A正确;
B.金属性为Ba>Ca>Ba,则对应元素的最高价氧化物的水化物的碱性为Ba(OH)2>Ca(OH)2>Mg(OH)2,故B正确;
C.非金属性Cl>S>P,则气态氢化物的稳定性为HCl>H2S>PH3,故C正确;
D.非金属性F>Cl>Br,对应离子的还原性为F-<Cl-<Br-,故D错误;
故选D.
本题解析:
本题难度:简单
4、选择题 下列叙述中正确的是( )
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.在同一周期中,ⅠA族比ⅡA族的单质与水反应更剧烈
D.在ⅠA族中,单质的熔、沸点随着原子半径的增大而逐渐升高
参考答案:A.O、F元素最高价为零,最高化合价在数值上不等于该元素所属的族序数,故A错误;
B.第六周期元素种类有32种,只有四、五周期含有18种元素,故B错误;
C.同周期元素从左到右元素的金属性逐渐降低,元素的金属性越强,单质的活泼性越强,则在同一周期中,ⅠA族比ⅡA族的单质与水反应更剧烈,故C正确;
D.碱金属元素从上到下对应单质的熔沸点逐渐降低,半径逐渐增大,所以在ⅠA族中,单质的熔、沸点随着原子半径的增大而逐渐降低,故D错误.
故选C.
本题解析:
本题难度:简单
5、推断题 短周期元素A、B、C、D中,0.5mol?A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g?A的氧化物恰好与100ml?0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外第三层电子数目比第一层多1个,C-比A元素的离子多1个电子层,D元素的原子核外第二层比第一层多2个电子。回答下列问题:
(1)A、B、C、D四种元素的名称分别是_______、_______、_______、_______;
(2)C-的结构示意图为_______;D元素在周期表中的位置是__________;
(3)元素D的最简单气态氢化物的电子式为____,其分子的结构特点是具有_____结构,在一定条件下该氢化物可与单质C发生取代反应,若将等物质的量的该氢化物与单质C混合,在一定条件下充分反应后,生成物中物质的量最大的是_______(用化学式填写);
(4)工业上冶炼单质A的化学方程式为_____________________________________;
(5)工业上常用单质B冶炼难熔的金属,写出氧化铁和单质B在高温下反应的化学方程式_________________,该反应属于______反应(填“放热”或“吸热”);
(6)写出工业上用石英晶体与D的一种单质生产半导体材料的化学反应方程式_________________________;
(7)将D的单质在足量的氧气中完全燃烧,所得产物的结构式为____________。
参考答案:(1)镁;铝;氯;碳
(2)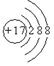 ;第二周期、ⅣA? ?
;第二周期、ⅣA? ?
(3)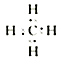 ;正四面体;HCl?
;正四面体;HCl?
(4)MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
(5)Fe2O3+2Al Al2O3+3Fe;放热?
Al2O3+3Fe;放热?
(6)?SiO2+2C?==Si+2CO↑
(7) 
本题解析:
本题难度:一般