1、填空题 氮及其化合物在工农业生产等方面有广泛应用,研究其性质有重要意义。
A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B。用圆底烧瓶收集干燥的B。按如图装置,引发紫色石蕊溶液上喷,可以得到蓝色喷泉;A与浓H2SO4反应,放出无色气体C。用圆底烧瓶收集干燥的C,仍按下图装置,引发紫色石蕊溶液上喷,可以得到红色喷泉。
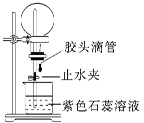
(1)写出A与浓NaOH溶液共热生成B的离子方程式
?;
(2)可用于除去B中水分的干燥剂是______________;
收集气体C的方法是______________________________;
(3)引发紫色石蕊溶液上喷的操作是?;
(4)在同温同压下,相同体积的两个烧瓶分别充满气体B和气体C,做喷泉实验后,水都充满烧瓶,两个烧瓶中所得溶液的物质的量浓度之比是_____________。
参考答案:(10分)(1)NH+OH-NH3↑+H2O (2)碱石灰向上排空气法
(3)打开止水夹,挤出胶头滴管中的水 (4)1:1
本题解析:(1)碱液能使石蕊试液显蓝色,则气体B应该是氨气,所以A应该是铵盐。A与浓H2SO4反应,放出无色气体C。且用无色气体C做喷泉实验可以得到红色喷泉,这说明C应该是氯化氢,所以A是氯化铵,则A与浓NaOH溶液共热生成B的离子方程式是NH+OH-NH3↑+H2O。
(2)氨气是碱性气体,不能用酸性干燥剂,也不能用氯化钙,应该用碱石灰做干燥剂。氯化氢极易溶于水,但氯化氢的密度大于空气的,所以收集氯化氢的方法是向上排空气法。
(3)引发紫色石蕊溶液上喷的操作是打开止水夹,挤出胶头滴管中的水。
(4)在相同条件下,等体积的氨气和氯化氢的物质的量是相等的,又因为水充满烧瓶,所以两个烧瓶中所得溶液的物质的量浓度之比是1:1的。
点评:该题是高考中的常见考点和题型,属于中等难度的试题。试题综合性强,侧重对学生实验能力的培养,有利于提升学生的学科素养,也有利于培养学生规范、严谨的实验设计能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
2、填空题 氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。根据
题意完成下列计算:
联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮
原子的质量分数为0.977,计算确定该氢化物的分子式为?。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积?L。
联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物
是氮气和水。由联氨和四氧化二氮组成的火箭推进剂恰好完全反应生成72.0 kg水,推进剂中联氨的质量为?kg。
氨的水溶液可用于吸收NO与NO2混合气体,可消除氮氧化合物对环境的污染。请分
别写出有关的反应方程式为:??; ?。
参考答案:
(1)HN3或N3H (1分)? 4.48(1分)?
(2)64 kg (2分)?
(3)4NH3+6NO=5N2+6H2O? (2分)? 8NH3+6NO2=7N2+12H2O (2分)(写成NH3· H2O也给分)
本题解析:(1)N(N)=43.0×0.977÷14=3,N(H)=(43.0-14×3)÷1=1,分子式为 HN3;
n(HN3)=4.30÷43=0.1mol,根据原子守恒得到n(H2)=0.05mol,n(N2)=0.15mol
标况下体积为(0.05+0.15)×22.4=4.48L
(2)该反应方程式为2N2H4+N2O4=3N2+4H2O,根据方程式计算可得m(N2H4)=64kg
(3)4NH3+6NO=5N2+6H2O ?8NH3+6NO2=7N2+12H2O
本题难度:一般
3、选择题 将4.8g镁粉投入500mL 1mol/L的稀HNO3中恰好完全反应,则还原产物是……(?)
A.N2O
B.N2
C.NO
D.NO2
参考答案:A
本题解析:可首先计算出两种反应物的物质的量之比,并任选一组整数比,根据质量守恒定律配成化学方程式,再通过观察确定还原产物。
由题意知n(Mg):n(HNO3)="4.8/24" :0.5×1=2:5=4:10,因为4个选项中HNO3的还原产物是N2或氮的氧化物,根据质量守恒定律可写出如下化学方程式:
4Mg+10HNO3=4Mg(NO3)2+5H2O+x
由观察法可以确定,x是由两个氮原子、一个氧原子构成的一个或几个分子,考查四个选项知它是N2O,
应选A。
本题难度:一般
4、实验题 (15分)下图所示是进行木炭与浓硝酸反应,并检验生成的气体和反应的热效应的实验装置,它具有无污染,现象明显的特点。具支试管A中所盛固体下层是无水CaCl2(作载体不参加反应),上层是红热的木炭。实验时慢慢将浓硝酸滴到木炭上,反应即开始进行
且能长时间剧烈反应。请回答下列问题:
 (1)写出木炭与浓硝酸反应的化学方式?。
(1)写出木炭与浓硝酸反应的化学方式?。
(2)实验中具支试管A内出现的现象是?。
(3)试管B内出现的现象为? ?;澄清石灰水中发生的主要反应的离子方程式为:?。
?;澄清石灰水中发生的主要反应的离子方程式为:?。
(4)某学生在实验临近结束时,发现滴管中的浓硝酸难以滴下。若要再滴入 几滴浓硝酸使
几滴浓硝酸使 木炭反应完全,最简单的办法是?。
木炭反应完全,最简单的办法是?。
参考答案:(15分,每题3分)(1)C+4HNO3 4NO2↑+CO2↑+2H2O)
4NO2↑+CO2↑+2H2O)
(2)炭块保持红热,试管内有红棕色气体生成
(3)试管内有红棕色气体生成,石灰水变浑浊,Ca2++2OH-+CO2=CaCO3↓+H2O
(4)摇动试管B,使上部的气体溶于石灰水(其他合理的答案也可)
本题解析:略
本题难度:一般
5、选择题 a mol氨完全氧化成HNO3,并且全部溶于反应生成的水中,得HNO3的质量分数约为
A.78%
B.42%
C.50%
D.63%
参考答案:A
本题解析:NH3+2O2===HNO3+H2O?
HNO3%=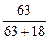 ×100%=78%
×100%=78%
本题难度:简单