1、选择题 已知1—18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是(?)
A.四种元素位于同一周期
B.氢化物的稳定性:H2Y>HZ
C.离子的氧化性:aW3+>bX+
D.a+3=c-2
参考答案:C
本题解析:aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,即这四种微粒的核外电子数相等。A.由于阳离子是原子失去电子形成的,形成的离子比原子少一个电子层;阴离子是原子获得电子形成的,离子的电子层数与原子相同。所以四种元素位于不同的周期。错误。B.由于Z、Y在同一周期,非金属性Z>Y。元素的非金属性越强,其对应的氢化物就越温度。故氢化物的稳定性: HZ >H2Y。错误。C.对于电子层结构相同的离子来说,离子的核电荷数越大,离子的半径就越小,离子的氧化性就越强。由于核电荷数离子aW3+>bX+,所以离子的的氧化性:aW3+>bX+。正确。D. aW3+是原子失去3个电子形成的,cY2-是原子获得2个电子形成的,由于二者的电子数相等,所以a-3=c+2.错误。
本题难度:一般
2、填空题 (15分) 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a
| ?
| ?
|
b
| ?
| ?
| ?
| c
| d
| e
| f
| ?
|
g
| h
| i
| j
| ?
| k
| l
| m
|
n
| ?
| ?
| ?
| ?
| ?
| ?
| o
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | |
|
试回答下列问题:
(1)请写出元素O的基态原子电子排布式??。
(2)c元素的一种同素异形体与熔融的n单质形成石墨间隙化合物,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见图,则x值为?。
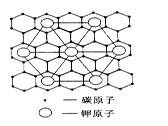
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表?(填元素符号);其中电负性最大的是?(填图中的序号)。

(4)由i原子跟d原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。则i与d形成的晶体中一个晶胞中含有4个i原子;与同一个i原子相连的d原子构成的空间构型为?,d原子的杂化类型为?。
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
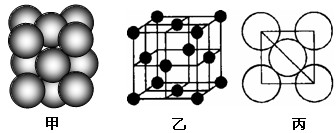
若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,
则该晶体的密度为______?_g/cm3?(用字母表示)。
参考答案:(1)元素O是铁,基态原子电子排布式1s22s22p63s23p63d64s2? (2) 8
(3) Si;? 2?(4) 正四面体? sp3?(5)
本题解析:(1)元素O是铁,由构造原理可得其基态原子电子排布式1s22s22p63s23p63d64s2;
(2)由图分析可得X为8;
(3)第三周期中硅为原子晶体,熔点最高;电负性最大即非金属性最强的为2;
(4)i原子跟d原子以1 : 1相互交替结合而形成的晶体为ALN晶体,其空间构型为正四面体形,d原子的杂化类型为sp3杂化;
(5)密度为
本题难度:一般
3、选择题 下列叙述不正确的是(?)
A.在NH4Cl中既有极性键又有非极性键
B.在元素周期表中,呈现+7价的元素一定位于ⅦA族
C.主族元素中,奇数族中的所有元素的原子序数都一定是奇数
D.同一周期从左到右元素的金属性逐渐减弱,这一规律对副族元素不成立
参考答案:AB
本题解析:在NH4Cl中没有非极性键;呈现+7价可能是Mn,位于ⅦB族;D选项中,Cu、Zn同位于第四周期,但Zn比Cu的金属性强。
本题难度:一般
4、选择题 下列变化规律错误的是
A.微粒半径:F-<Cl-<Br-<I-
B.稳定性:HI<HBr<HCl<HF
C.沸点:HF<HCl<HBr<HI
D.阴离子还原性:F-<Cl-<Br-<I-
参考答案:C
本题解析:由于HF分子中含有氢键,所以沸点比其他的卤化氢的沸点高。
本题难度:一般
5、填空题 ( 7分 )同一周期的主族元素,从左到右,原子半径逐渐?,得电子能力逐渐______,非金属性逐渐______;同一主族元素,从上到下原子半径逐渐?,失电子能力逐渐______,单质的还原性逐渐______,氧化性逐渐______。
参考答案:减小;增强;增强;增大;增强;增强;减弱
本题解析:同一周期的主族元素,从左到右,原子半径逐渐减小,得电子能力逐渐__增强_,非金属性逐渐___增强___;同一主族元素,从上到下原子半径逐渐?增大?,失电子能力逐渐___增强___,单质的还原性逐渐__增强____,氧化性逐渐___减弱___。
本题难度:简单