1、选择题 生产、生活中处处有化学,下列有关说法不正确的是( )
A.地球上CO2气体含量上升容易导致温室效应,进而引发灾难性气候
B.食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯
C.不锈钢和目前流通的硬币都是合金
D.春节时燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
参考答案:A.CO2是导致温室效应的主要气体,过度排放可引发灾难性气候,故A正确;
B.食品保鲜膜、一次性食品袋的主要成分是聚乙烯,不能使用聚氯乙烯,聚氯乙烯对人体有害,故B错误;
C.不锈钢为镍铬合金,硬币多为铜镍合金、铜锌合金等,都与合金组成,故C正确;
D.金属元素在灼烧时发生焰色反应,呈现不同的颜色,故D正确.
故选B.
本题解析:
本题难度:一般
2、填空题 近年来,由于石油价格的不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以煤为原料生产聚乙烯(PVC)和人造羊毛的合成线路。

请回答下列问题:
(1)写出反应类型:反应①______________,反应②__________________。
(2)写出结构简式:PVC________________,C______________________。
(3)写出A  D的化学方程式_______________________________。
D的化学方程式_______________________________。
(4)与D互为同分异构体且可发生碱性水解的物质有________种(不包括环状化合物),写出其中一种的结构简式_______________________________________。
参考答案:(1)加成反应;加聚反应。
(2)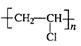 ?;H2C=HC-CN。
?;H2C=HC-CN。
(3)HC≡CH+CH3COOH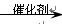 H2C=CH-OOCCH3
H2C=CH-OOCCH3
(4)4;CH2=CHCOOCH3。
本题解析:根据人造羊毛的结构可判断C和D的结构分别为CH2=CHCN和CH2=CH—OOCCH3;由A生成C的条件可推断A为乙炔。则与HCl加成后生成的氯乙烯加聚可以得到聚氯乙烯。
本题难度:一般
3、选择题 不能被人体消化吸收的高分子化合物是( )
A.葡萄糖
B.淀粉
C.纤维素
D.蛋白质
参考答案:A、葡萄糖不需要消化,可以被人体直接吸收,不属于高分子化合物,故A错误;
B、淀粉是天然高分子化合物,在人体内相应酶的作用下,最终水解为葡萄糖,被消化吸收,故B错误;
C、纤维素是天然高分子化合物,但人体内没有纤维素酶,不能消化吸收纤维素,故C正确;
D、蛋白质是天然高分子化合物,在人体内相应酶的作用下,最终水解为氨基酸,被消化吸收,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 PHB塑料是一种可在微生物作用下降解的环保型塑料,其结构简式为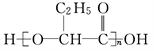 ,下面有关PHB说法不正确的是?
,下面有关PHB说法不正确的是?
A.PHB通过加聚反应制得.
B.PHB的单体是CH3CH2CH(OH)COOH
C.PHB在微生物作用下的降解产物可能有CO2和H2O
D.PHB是一种聚酯
参考答案:A
本题解析:A.PHB通过缩聚反应制得,错误;B.PHB的单体是CH3CH2CH(OH)COOH,正确;C.PHB水解得到CH3CH2CH(OH)COOH,CH3CH2CH(OH)COOH在微生物作用下的降解产物可能有CO2和H2O,正确;D.PHB是CH3CH2CH(OH)COOH发生缩聚反应产生的物质,所以是一种聚酯,正确。
本题难度:一般
5、填空题 [化学一选修2:化学与技术](15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水的处理主要包括水的净
化、污水处理、硬水软化和海水的淡化等。
(1)海水的淡化常用的方法有_________、_________、电渗析法等。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。
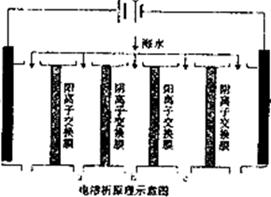
①阳极(惰性电极)的电极反应式为 __________________.
②淡水的出口为a、b、c中的_________ 出口。
③某出口排出的浓海水中溴元素的含量为0.68g/L,现用氯气将其中的溴离子氧化为溴单质,则处理l.0×10 L该浓海水需标况下的氯气的体积为_________
L该浓海水需标况下的氯气的体积为_________ 。
。
(3) K2FeO4是自来水厂常用的消毒、净化剂。工业上常用Fe(NO3)3溶液与浓KCIO溶液在强碱性环境中生成K2FeO4,该反应的离子方程式为___________________________.
(4)氯碱工业常用_________(填“阴”或“阳”)离子交换膜电解槽电解精制的饱和食盐水,?若食盐水中含有杂质MgCl2则会对离子交换膜电解槽造成损害,其原因是_______ (用离子方程式表示)。
(5)工程塑料ABS合成时,用了以下三种单体: 、
、
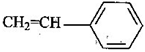 ,请写出ABS的结构简式_______________________________。
,请写出ABS的结构简式_______________________________。
参考答案:(1)蒸馏法(1分) 离子交换法 (1分)
(2)① 4OH― -4e-?= 2H2O+O2 ↑ (2分)
② b? (2分)?
③ 9.52? (2分)
(3)2 Fe3+ + 3 ClO― + 10 OH― ="2" FeO42- + 3 Cl― + 5 H2O (2分)
(4)阳?(1分);
Mg2+ + 2Cl― + 2H2O? ?Cl2 ↑+ H2 ↑ + Mg(OH)2 ↓ (2分)
?Cl2 ↑+ H2 ↑ + Mg(OH)2 ↓ (2分)
(5) 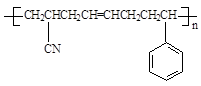 ?(2分)
?(2分)
本题解析:(1)海水的淡化常用的方法有蒸馏法、离子交换法、电渗析法等;
(2)①阳极是阴离子放电,所以阳极是氢氧根离子放电生成氧气,电极反应式为4OH― -4e-?= 2H2O+O2 ↑②在电场作用下,海水的阳离子趋向阴极,阴离子趋向阳极,但阳离子只能透过阳膜,却被相邻的阴膜阻挡,阴离子与此相反,所以淡水从b口出;
③l.0×10 L该浓海水中含有溴元素的物质的量是l.0×10
L该浓海水中含有溴元素的物质的量是l.0×10 L×0.68g/L÷80g/mol,需要氯气标准状况下的体积是l.0×10
L×0.68g/L÷80g/mol,需要氯气标准状况下的体积是l.0×10 L×0.68g/L÷80g/mol÷2×22.4L/mol=9520L=9.52m3;
L×0.68g/L÷80g/mol÷2×22.4L/mol=9520L=9.52m3;
(3)根据氧化还原反应理论,Fe(NO3)3溶液与浓KClO溶液在强碱性中生成K2FeO4及氯化钾、水,离子方程式为2 Fe3+ + 3 ClO― + 10 OH― ="2" FeO42- + 3 Cl― + 5 H2O;
(4)氯碱工业常用阳离子交换膜电解槽电解精制的饱和食盐水,若盐水中含有杂质MgCl2,镁离子通过阳离子交换膜与阴极的氢氧根离子结合生成氢氧化镁沉淀堵塞离子交换膜,发生的离子方程式为? Mg2++2Cl―+2H2O Cl2↑+ H2↑+Mg(OH)2↓
Cl2↑+ H2↑+Mg(OH)2↓
(5)CH2=CH-CN与苯乙烯中含有1个碳碳双键,而1,3-丁二烯中含有2个碳碳双键,所以三者发生加聚反应时1,3-丁二烯中的碳碳双键断裂分别与CH2=CH-CN与苯乙烯中碳碳双键发生加成聚合反应,所以?产物的结构简式为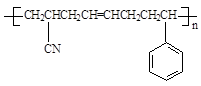
本题难度:一般