1、选择题 下列各组粒子中属于同位素的是( )
A.16O和18O
B.H2O和D2O
C.H2和D2
D.24Mg和24Na
参考答案:A
本题解析:质子数相同,中子数不同的同一种元素的不同核素互称为同位素,所以选项A正确,其余选项不是同位素的关系,答案选A。
点评:判断同位素的关键是微粒是不是是核素,其次是否满足质子数相同而中子数不同。
本题难度:简单
2、填空题 甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系。
甲+乙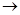 丙+丁
丙+丁
(1)转化关系中所涉及的反应甲和乙为非氧化还原反应,且乙为水。 若甲为固体,甲和乙反应生成的丙和丁是二种弱碱。则甲的化学式是?。
(2)转化关系中所涉及的反应为氧化还原反应,且乙为水。
① 若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是?。
② 若丙和丁都可在一定条件下还原CuO,甲+乙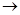 丙+丁
丙+丁
写出该反应的化学方程式:?。
③ 若甲是由N和O元素组成的气态红棕色物质。将3.36 g Fe加到一定量丙稀溶
液中,收集到1.12 L气体丁(已折算为标准状况),则反应的离子方程式是:
?。
参考答案:(8分,每空2分)(1)Mg3N2?(2)①2Na+2H2O = 2Na++2OH-+H2↑
②C(s)+H2O(g) CO(g)+H2(g)③6Fe+2H++5NO3-= 3Fe2++3Fe3++5NO ↑+10H2O
CO(g)+H2(g)③6Fe+2H++5NO3-= 3Fe2++3Fe3++5NO ↑+10H2O
本题解析:(1)由于甲和乙反应生成的丙和丁是二种弱碱,所以符合条件的是氮化镁,化学式是Mg3N2,和水反应生成氨气和氢氧化镁。
(2)① 若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,则甲应该是钠,反应的离子方程式是2Na+2H2O = 2Na++2OH-+H2↑。
② 若丙和丁都可在一定条件下还原CuO,则该反应应该是制备水煤气的反应,方程式是C(s)+H2O(g) CO(g)+H2(g)。
CO(g)+H2(g)。
③甲是由N和O元素组成的气态红棕色物质,则甲是NO2。NO2溶于水生成NO和硝酸,这说明丙是硝酸。3.36铁的物质的量是0.06mol。稀硝酸的还原产物是NO,则NO的物质的量是0.05mol,因此反应中转来源:91考试网 www.91eXam.org移0.05mol×3=0.15mol电子。设生成的亚铁离子和铁离子的物质的量分别是x和y,则x+y=0.06mol、2x+3y=0.15mol。解得x=y=0.03mol,所以该反应的离子方程式是6Fe+20H++5NO3-= 3Fe2++3Fe3++5NO ↑+10H2O。
点评:该题是中等难度的试题,试题基础性强,难易适中。该题在注重对学生基础性棕色巩固与检验的同时,侧重对学生能力的培养和解题方法的指导。该题最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
3、选择题 下列氮原子结构的表述中,对电子运动状态描述正确且能表明同一电子层电子能量有差异的是(?)C?原子结构
A.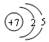
B.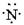
C.1s22s22p3
D.
参考答案:C
本题解析:略
本题难度:一般
4、填空题 (14分)
下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答下列问题:

(1)元素③形成的单质的电子式为?;元素②形成的最高价氧化物的结构式为?。
(2)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为?。
(3)②、③、④、⑤元素形成的氢化物中,热稳定性最强的是?(填化学式),沸点最高的是?(填化学式)。
(4)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较?>?(填化学式)。
(5)用电子式表示⑥、⑧两元素结合成化合物的形成过程?。
(6)元素⑩在周期表中的位置?;该元素的单质主要用途?(填一种)。
参考答案:(14分)

本题解析:略
本题难度:简单
5、选择题 l3C?—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是(?)
A.13C与15N有相同的中子数? B.13C与C60互为同素异形体
C. 15N与14N互为同位素?D.15N的核外电子数与中子数相同
参考答案:C
本题解析:A.13C与15N的中子数分别为7、8,故A错误;
B.13C为原子,C60为单质,二者不是同素异形体,故B错误;
C.15N与14N为质子数都是7,但中子数不同的原子,则互为同位素,故C正确;
D.15N的核外电子数为7,中子数为15-7=8,故D错误;
故选C。
点评:本题考查原子的构成及原子中的数量关系,较简单,熟悉同位素、同素异形体的概念及判断可解答。
本题难度:简单