1、选择题 依据氨气在下图所示装置能形成喷泉的原理,在该装置的烧瓶中充满指定气体,胶头滴管中吸入指定液体,以下各组物质不能形成喷泉现象的是(?)
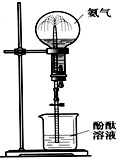
A.二氧化碳和氢氧化钠溶液
B.一氧化氮和水
C.二氧化硫和水
D.氯化氢和水
参考答案:B
本题解析:略
本题难度:简单
2、选择题 当氨气和空气一起通过加热的铂催化剂时,下列物质中不可能是反应生成物的是?
A.NO
B.N2
C.NO2
D.NH4NO3
参考答案:B
本题解析:氨气经催化氧化可生成NO和H2O,由于NO极易被氧化,故反应会生成少量NO2;NO2溶于水生成的HNO3会吸收部分氨气生成NH4NO3,故不可能生成的物质即是N2。
4NH3+5O2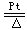 4NO+6H2O,2NO+O2=2NO2
4NO+6H2O,2NO+O2=2NO2
3NO2+H2O=2HNO3+NO,HNO3+NH3=NH4NO3。
本题难度:一般
3、填空题 某种常见的晶体A,与盐酸反应产生无刺激性气味的气体B。将B通入澄清石灰水中,石
灰水变浑浊。若在A的溶液中加氢氧化钡溶液,则析出白色沉淀C和无色气体D;D可以使湿润的红色石蕊试纸变蓝。加热固体A,可生成水、B和D,而且B和D的物质的量之比为1∶1。根据以上事实可以判断出A是__________,B是__________,C是__________。加热固体A生成水、B和D的化学方程式是__________。
参考答案:NH4HCO3? CO2? BaCO3? NH4HCO3 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
本题解析:由无色无味的气体B通入澄清石灰水中变浑浊,知B为CO2,说明A中含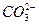 或
或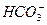 ;D能使湿润的红色石蕊试纸变蓝,D为NH3,则A中含
;D能使湿润的红色石蕊试纸变蓝,D为NH3,则A中含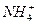 ,A受热生成的CO2和NH3物质的量比为1∶1,A为NH4HCO3。
,A受热生成的CO2和NH3物质的量比为1∶1,A为NH4HCO3。
本题难度:简单
4、计算题 某合成氨厂,日生产能力为30吨,现以NH3为原料生产NH4NO3,若硝酸车间的原料转化率为92%,氨被吸收为NH4NO3的吸收率为98%,则硝酸车间日生产能力应为多少吨才合理?
参考答案:硝酸车间日生产能力为52.76 t才合理。
本题解析:解此题必须注意以下三点:
第一,合成氨厂日生产能力为30吨,现以NH3为原料生成NH4NO3.NH3的用途有两方面:一方面,用NH3氧化制HNO3,另一方面用NH3与制得的HNO3作用制NH4NO3。关键是计划好生产多少吨HNO3,才能使NH3原料最大限度地被利用。HNO3生产少了,则NH3不能全部被HNO3吸收,NH3浪费了,HNO3生产多了,HNO3又浪费了。所以设HNO3日生产能力为x吨,x吨HNO3需用多少吨NH3氧化制得,又可以吸收多少吨NH3生成NH4NO3,通过生产HNO3的数量把氨的两方面用途联系起来。
第二,氨氧化制硝酸中,其关系式如下:
4NH3+5O2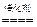 4NO+6H2O
4NO+6H2O
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
此反应中NO是被循环利用的,即NO又被氧化成NO2,再与水作用生成HNO3,因此NO2与水反应的化学方程式应为:
4NO2+2H2O+O2=4HNO3
所以氨氧化制硝酸的关系式如下:
NH3~NO~NO2~HNO3(NH3全部转化成HNO3)
第三,在实际生产过程中,氨不可能100%被氧化生成HNO3,也不可能100%被HNO3吸收生成硝酸铵,题给条件是NH3转化为硝酸的转化率为92%,氨被硝酸吸收的吸收率为98%,在数量关系上,我们必须掌握住一条原则,代入化学方程式的量必须是纯量.
设日产HNO3的质量为x,NH3用于生产HNO3的质量为y.
由各步反应方程式得氨氧化制HNO3的关系为:
NH3~NO~NO2~HNO3
17? 63
y·92%?x
y=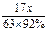
用于被HNO3吸收的NH3质量为(30 t-y):
30 t-y=30 t-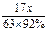
由 NH3?+?HNO3?=? NH4NO3
17 ?63
(30 t-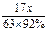 )×98%?x
)×98%?x
得:[30t-17x/(63×92%)]·98%=17x/63
解之得:x=52.76 t。
本题难度:简单
5、选择题 NH4HCO3是一种离子化合物,下列关于该物质的叙述错误的是
A.所含四种元素的原子半径由小到大的顺序为:H<O<N<C
B.同周期的三种元素的得电子能力由大到小的顺序为: O>N>C
C.除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法
D.其与足量氢氧化钠溶液共热的离子方程式为:NH4++OHˉ NH3↑+H2O
NH3↑+H2O
参考答案:D
本题解析:A.H是第一周期的元素,原子核外有一个电子层,C、N、O都是第二周期的元素,原子核外有两个电子层。对于电子层数不同的元素来说,原子的电子层数越多原子半径越大;对于电子层数相同的元素来说,元素的原子序数越大,原子半径就越小。所以这四种元素的原子半径由小到大的顺序是H<O<N<C。正确。B.同周期的三种元素从左到右,元素的非金属性逐渐增强,元素的原子得到电子的能力逐渐增强。故得电子能力由大到小的顺序为: O>N>C 。正确。C.加热时NH4HCO3发生分解反应:NH4HCO3 NH3↑+H2O+CO2↑。不会有残留的固体杂质。因此可以采用加热的方法除去NaCl固体中混有少量的NH4HCO3杂质。正确。D.NaOH与NH4HCO3电离产生的阴离子、阳离子均发生反应。故其与足量氢氧化钠溶液共热的离子方程式为:HCO3-+NH4++2OHˉ
NH3↑+H2O+CO2↑。不会有残留的固体杂质。因此可以采用加热的方法除去NaCl固体中混有少量的NH4HCO3杂质。正确。D.NaOH与NH4HCO3电离产生的阴离子、阳离子均发生反应。故其与足量氢氧化钠溶液共热的离子方程式为:HCO3-+NH4++2OHˉ NH3↑+H2O + CO32-.错误。4HCO3的化学性质的知识。
NH3↑+H2O + CO32-.错误。4HCO3的化学性质的知识。
本题难度:简单