1、选择题 下表是五种银盐的溶度积常数(25 ℃),下列有关说法错误的是( )
化学式
| AgCl
| Ag2SO4
| Ag2S
| AgBr
| AgI
|
溶度积
| 1.8×10-10
| 1.4×10-5
| 6.3×10-50
| 7.7×10-13
| 8.5×10-16
|
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将AgCl溶解于水后,向其中加入Na2S,则可以生成黑色的Ag2S沉淀
C.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
D.常温下,AgCl、AgBr和AgI三种物质的溶解度逐渐增大
参考答案:D
本题解析:根据Ksp可以看出Ag2SO4的溶解度最大,A对。溶解度大的难溶物容易转变成溶解度小的难溶物,B对。外界条件改变,沉淀溶解平衡移动,C错。所以错误的选项是D。
点评:Ksp不能直接确定溶解度的大小,但是对于同一类型的物质,Ksp越大,溶解度越大。
本题难度:一般
2、填空题 下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
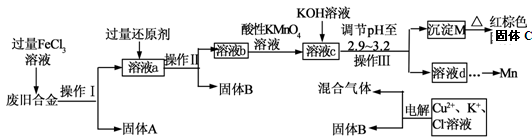
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是?。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:?。
(3)过量的还原剂应是?。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为?。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为?g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为:?﹥?﹥??。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为?L(用含Z的代数式表示);该电极的反应式为? .
参考答案:(1)过滤(1分)
(2)2FeCl3 +Fe = 3FeCl2(2分);? 2FeCl3 + Cu= 2FeCl2 +CuCl2(2分)
(3)Cu粉(2分)?
(4)①? MnO4- + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O(2分)?② 0.4XY(2分)
(5)Fe3+>Cu2+>Mn2+(2分)?
(6)22.4Z/64 (2分);? 4OH-?―4e-=O2↑?+ 4H2O(2分)
本题解析:根据题给流程图和信息知,废旧合金(含有Cu、Fe、Si 三种成分)与过量FeCl3溶液混合发生的反应为2FeCl3 +Fe = 3FeCl2;2FeCl3 + Cu= 2FeCl2 +CuCl2,过滤,固体A的成分为Si,溶液a的成分为FeCl3 、FeCl2 和CuCl2的混合液;电解含Cu2+、Cl—、K+的溶液的固体B,B的成分为Cu;溶液a加过量还原剂反应后过滤得固体B(Cu),则还原剂为铜,发生的反应为2FeCl3 + Cu= 2FeCl2 +CuCl2,溶液b的成分为FeCl2 和CuCl2的混合液;溶液b中加入酸性高锰酸钾溶液,亚铁离子被氧化为铁离子,用氢氧化钾溶液调节溶液的PH,铁离子转化为氢氧化铁沉淀,灼烧的氧化铁,溶液d经处理的金属锰。(1)由流程图知,操作Ⅰ、Ⅱ、Ⅲ为分离固液混合物的操作,指的是过滤;(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:2FeCl3 +Fe = 3FeCl2;2FeCl3 + Cu= 2FeCl2 +CuCl2;(3)由上述分析知,过量的还原剂应是Cu粉;(4)①向溶液b中加入酸性KMnO4溶液亚铁离子被氧化为铁离子,反应的离子方程式为MnO4- + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O;②根据相关反应的关系式:2MnO4-—— 10Fe2+——5Fe2O3,用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为0.4XYg;(5)根据题意知,溶液c中所含的金属阳离子为Fe3+、Cu2+和Mn2+,若三者浓度相等,向溶液c中逐滴加入KOH溶液,根据题给溶度积产生判断,Fe3+所需氢氧根浓度最小先沉淀,Mn2+所需氢氧根浓度最大,最后沉淀,则三种金属阳离子沉淀的先后顺序为:Fe3+>Cu2+>Mn2+;(6)根据题意知,电解过程的电极反应式依次为:阳极:4OH-?―4e-=O2↑?+ 4H2O;阴极:Cu2+ + 2e-= Cu;2H+ + 2e- = H2↑;根据电子守恒计算,标况下阳极生成的最后一种气体体积为22.4Z/64L。
本题难度:困难
3、简答题 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
已知:SO2+
O2?SO3△H=-98KJ?mol-1
(1)在T1温度时,该反应的平衡常数K=,若在此温度下,向100L的恒容密闭容器中,充入3.0molSO2、16.0molO2和3.0molSO3,则反应开始时正反应速率______逆反应速率(填“<”、“>”或“=”).
(2)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ.此时二氧化硫的转化率为______.
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2平衡浓度比原来减小的是______(填字母).
A.保持温度和容器体积不变,充入1.0molO2
B.保持温度和容器内压强不变,充入2.0molSO2和5.0molO2
C.降低温度
D.在其他条件不变时,减小容器的容积
(4)有人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______.
(5)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,=______.[已知该温度时,KSP(BaSO4)=1.3×10-10,KSP(BaCO3)=5.2×10-9].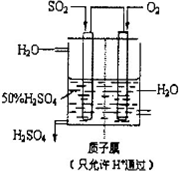
参考答案:(1)SO2+12O2?SO3△H=-98KJ?mol-1,向100L的恒容密闭容器中,充入3.0molSO2、16.0molO2和3.0molSO3,
因为浓度商QC=c(SO3)c(SO2)[c(O2)]12=3.0mol100L3.0mol100L×(16.0mol100L)12=2.5>K,所以化学反应正向进行,即v(正)>v(逆),故答案为:>;
(2)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ根据1molSO2完全反应放热98KJ;则一定条件下当反应达到平衡时共放出热量196kJ,消耗二氧化硫物质的量=1mol×196KJ98KJ=2mol;依据化学平衡三段式列式计算:
? ?SO2(g)+12O2(g)?SO3(g)
开始量(mol)?4? 10? 0
变化量(mol)? 2? 1?2
平衡量(mol) ?2?9? 2
所以SO2的转化率α=2mol4mol×100%=50%,故答案为:50%;
(3)A、保持温度和容器体积不变,O2的浓度增大,平衡正向移动,SO2的浓度减小,所以A正确;
B、保持温度和容器内压强不变,充入2.0molSO2和5.0molO2,新的平衡与原平衡等效,SO2的浓度不变,所以B错误;
C、降低温度,平衡向放热的方向移动,而正反应为放热,所以平衡正向移动,SO2的浓度减小,所以C正确;
D、在其他条件不变时,减小容器的容积,SO2的浓度瞬间增大,之后平衡向气体体积减少的方向移动,即向正反应方向移动,SO2的浓度减小,再次到达平衡时SO2的浓度仍比原来大,所以D错误.
故答案为:A、C;
(4)依据图装置分析,二氧化硫失电子发生氧化反应,二氧化硫被氧化为三氧化硫溶于水生成硫酸;电极反应为:SO2+2H2O=SO42-+4H++2e-;
故答案为:SO2+2H2O=SO42-+4H++2e-;?
(5)在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,依据溶度积常数可知沉淀向硫酸钡沉淀分析转化,BaCO3+SO42-=BaSO4+CO32-;结合碳酸钡和硫酸钡溶度积常数;
c(CO22-)c(SO42-)=Ksp(BaCO3)Ksp(BaSO4)=5.2×10-91.3×10-10=40;
故答案为:40;
本题解析:
本题难度:一般
4、选择题 已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。下列关于难溶物之间转化的说法中错误的是? ( )
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于6.34×10-12mol·L-1
参考答案:A
本题解析:Ksp(AgI)小于Ksp(AgCl),AgI比AgCl更难溶于水,AgCl可以转化为AgI,饱和AgCl溶液中Ag+浓度为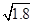 ×10-5 mol·L-1,根据c(Ag+)·c(I-)>Ksp(AgI)时产生AgI沉淀,I-的浓度必须不低于
×10-5 mol·L-1,根据c(Ag+)·c(I-)>Ksp(AgI)时产生AgI沉淀,I-的浓度必须不低于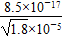 mol·L-1=6.34×10-12 mol·L-1。
mol·L-1=6.34×10-12 mol·L-1。
本题难度:简单
5、选择题 室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。已知CaCO3的溶度积(室温)为2.8×10-9,下列说法?中不正确的是(?)
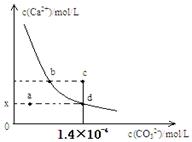
A.x的数值为2×10-5
B.c点时有CaCO3生成
C.加入蒸馏水可使溶液由d点变成a点
D.b点与d点对应的溶度积相等
参考答案:C
本题解析:略
本题难度:简单