1、选择题 下列递变规律正确的是
[? ]
A.HClO4、H2SO4、H3PO4的酸性依次增强?
B.HCl、HBr?、HI的稳定性依次增强
C.钠、镁、铝的还原性依次减弱?
D.N、O、F原子半径逐渐增大
参考答案:C
本题解析:
本题难度:一般
2、填空题 为验证干燥的Cl2没有漂白性,而Cl2与水反应后的产物具有漂白性,肖飞同学设计了如下实验。(其中a是有色布条)
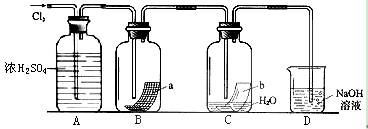
⑴ A中浓硫酸的作用是 ??。
⑵ 实验中观察到的现象是 ??,
可以得出的结论是 ?_____。
⑶ D装置的作用是 ??,其中发生的化学反应方程式是 ?______________________________________________
参考答案:⑴ 干燥氯气
⑵B中的有色布条不退色,C中的有色布条退色。
干燥的Cl2没有漂白性,而Cl2与水反应后的产物具有漂白性。
⑶ 吸收尾气 ,Cl2+2NaOH=NaCl+NaClO+H2O
本题解析:略
本题难度:简单
3、选择题 已知短周期元素的离子。aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
[? ]
A.原子半径 A>B>D>C
B.原子序数 d>c>b>a
C.离子半径 C>D>B>A
D.单质的还原性 A>B>D>C
参考答案:C
本题解析:
本题难度:一般
4、选择题 X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,下列叙述正确的是
A.R一定是气态
B.R一定是离子化合物
C.R一定是共价化合物
D.R可能是离子化合物,也可能是共价化合物
参考答案:D
本题解析:试题分析:X、Y都是短周期元素,所以X、Y的原子序数不大于18;主族元素中,元素的最外层电子数=其族序数,所以X是第ⅠA族元素,可能是H或Li或Na元素;Y元素的最高正价与最低负价的代数和为6,主族元素中元素的最高正价=族序数,最低负价=族序数-8,所以该元素属于第ⅥⅠA元素,F元素没有正价,所以Y是氯元素;X和Y两元素形成的化合物为HCl或LiCl或NaCl,离子化合物是由阳离子和阴离子构成的化合物,以共价键结合形成的化合物,叫做共价化合物.
A、R可能是气态物质,如氯化氢;也可能是固态物质,如LiCl和NaCl,故A错误.
B、R不一定是离子化合物,如氯化氢,故B错误.
C、R不一定是共价化合物,如LiCl和NaCl,故C错误.
D、R可能是共价化合物,如氯化氢;也可能是离子化合物,如LiCl和NaCl,故D正确.
故选D。
考点:离子化合物的结构特征与性质 共价键的形成及共价键的主要类型
点评:本题考查了元素的推断、化学键的判断等知识点,难度不大,注意:1离子化合物中可能含有共价键,如NaOH;2共价化合物中一定没有离子键;3稀有气体是单原子分子,不存在化学键,只存在分子间作用力。
本题难度:简单
5、选择题 下列有关物质的性质或应用均正确的是
A.工业上分别用电解氧化镁和氧化铝的方法制备镁和铝
B.为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰
C.氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂
D.Na2CO3受热能分解产生CO2气体,在食品工业中可作为焙制糕点的膨松剂
参考答案:C
本题解析:A、工业上分别用电解氯化镁制备金属镁,错误;B、生石灰是干燥剂,为防止月饼等富脂食品氧化变质应加还原剂如铁粉等,错误; C、氢氧化镁不仅分解时吸收大量的热量降低温度,而且分解产物为耐高温的氧化镁阻止燃烧,正确;D、Na2CO3稳定性好受热不易分解,焙制糕点的膨松剂为碳酸氢钠,错误。
本题难度:一般