1、选择题 下列分离或提纯物质的方法正确的是( )
A.用蒸馏法进行海水淡化
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D.用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
参考答案:解;A.水和盐的沸点不同,可用蒸馏的方法淡化海水,故A正确;
B.淀粉胶体和NaCl溶液都能透过滤纸,不能用过滤的方法分离,可用渗析法分离,故B错误;
C.BaSO4的BaCO3都不溶于水,可加入盐酸分离,故C错误;
D.加热时,CaCl2、MgCl2都不能分解、挥发,不能分离杂质,应用化学法除杂,故D错误.
故选A.
本题解析:
本题难度:简单
2、选择题 可以一次鉴别出乙酸、乙醇、乙酸乙酯、葡萄糖四种物质的试剂是
A.溴水
B.Na2CO3溶液
C.石蕊试液
D.碱性Cu(OH) 2悬浊液
参考答案:D
本题解析:A、葡萄糖含有醛基,能被溴水氧化,但溴水不能鉴别乙醇和乙酸,故A错误;B、碳酸钠溶液与乙醇、葡萄糖互溶,与乙酸反应放出CO2气体,与乙酸乙酯分层,因此不能鉴别乙醇与乙酸,B不正确;C、乙酸能使石蕊试液显红色,但石蕊试液不能鉴别乙醇、葡萄糖以及乙酸乙酯,C不正确;D、乙醇和Cu(OH)2不反应,乙酸与Cu(OH)2发生中和反应而使Cu(OH)2溶解,葡萄糖含有醛基,能与新制的Cu(OH)2悬浊液发生反应生成红色沉淀,乙酸乙酯和水互不相溶,即乙酸乙酯与碳酸钠溶液混合分层,可鉴别,故D正确,答案选D。
本题难度:一般
3、选择题 有四瓶溶液:(NH4)2SO4、NH4Cl、Na2CO3、NaNO3,若仅使用一种试剂就能将它们区别开,该试剂是(?)
A.Ba(OH)2溶液
B.NaOH溶液
C.BaCl2溶液
D.AgNO3溶液
参考答案:A
本题解析:阳离子有钠离子和铵根离子,所以考虑所加试剂阴离子中有氢氧根离子,硫酸铵与氯化铵中阴离子不同,可用氢氧化钡溶液鉴别。氢氧化钡溶液与硫酸铵、氯化铵、碳酸钠、硝酸钠反应现象分别为:既有白色沉淀又有刺激性气味气体、只有刺激性气味气体、只有白色沉淀、无现象。
点评:鉴别不同的物质一定要产生不同的现象。
本题难度:一般
4、选择题 下列实验操作不正确的是(?)
A.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体时即停止加热
B.除去Fe(OH)3胶体中混有的Cl?离子,可用渗析的方法
C.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
D.用四氯化碳萃取碘时,碘的四氯化碳溶液从分液漏斗上口倒出
参考答案:D
本题解析:
试题解析:四氯化碳的密度大于水的密度,用四氯化碳萃取碘时,碘的四氯化碳溶液从分液漏斗下口倒出,分液时遵循“上上下下” 的原则,即上层液体走上口,下上层液体走下口。D错误。
本题难度:简单
5、实验题 Na2SO3、SO2是中学常见的物质。
(1)某同学用下图示装置制取干燥纯净的SO2。
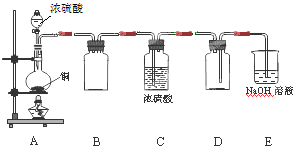
写出制取SO2气体的化学方程式?。请指出D装置中的错误?。若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是?。
(2)向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色。反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告。限选试剂:2 mol/LHCl,1 mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1 mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水。
编号
| 实验操作
| 预期现象和结论
|
步骤①
| 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色。
| ?,证明待测液中含Br-。
|
步骤②
| 在试管B中加入少量待测液,?
?
?
| 有白色沉淀生成,
证明待测液中含SO42-。
|
步骤③
| 在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴______(填试剂),振荡。
| ?,
证明待测液中含SO32-。
|
?
参考答案:(1)Cu + 2H2SO4 CuSO4 + SO2↑+ 2H2O(2分)?进气管比出气管短(2分)
CuSO4 + SO2↑+ 2H2O(2分)?进气管比出气管短(2分)
立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液 (2分)?
(2)
编号
实验操作
预期现象和结论
步骤①
?
溶液分层,下层呈橙红色(2分)
步骤②
加入过量的2mol/L盐酸,再滴加1mol/L BaCl2溶液(2分)
?
步骤③
新制饱和溴水(2分)
溴水褪色(2分)
本题解析:(1)根据题给装置图分析,制取SO2气体的原理是铜和浓硫酸共热生成硫酸铜、二氧化硫和水,化学方程式为Cu + 2H2SO4 CuSO4 + SO2↑+ 2H2O;D装置为二氧化硫的收集装置,二氧化硫的密度比空气大,应用向上排空气法收集,装置中的错误是进气管比出气管短;若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液;(2)鉴定混合液中的SO32-、SO42-和Br-离子,根据题给试剂设计实验方案。①取少量待测液于试管A中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色,溴溶解在四氯化碳中,下层为橙红色,说明含Br-,②取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液,观察到白色沉淀的生成,说明含SO42-;③在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴新制溴水,振荡,新制饱和溴水与亚硫酸根离子的氧化还原反应,观察溴水褪色,说明含SO32-。
CuSO4 + SO2↑+ 2H2O;D装置为二氧化硫的收集装置,二氧化硫的密度比空气大,应用向上排空气法收集,装置中的错误是进气管比出气管短;若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液;(2)鉴定混合液中的SO32-、SO42-和Br-离子,根据题给试剂设计实验方案。①取少量待测液于试管A中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色,溴溶解在四氯化碳中,下层为橙红色,说明含Br-,②取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液,观察到白色沉淀的生成,说明含SO42-;③在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴新制溴水,振荡,新制饱和溴水与亚硫酸根离子的氧化还原反应,观察溴水褪色,说明含SO32-。
本题难度:一般