1、填空题 某原电池中,电解质溶液为KOH(aq),分别向负极通入C2H4或Al(g),分别向正极通入O2或Cl2.试完成下列问题:
(1)当分别通入C2H4和O2时: ①正极反应:___________; ②负极反应:__________;
③电池总反应:________________________;
④溶液pH的变化:__________(填“增大”“减小”或“不变”,下同).
(2)当分别通入Al(g)和Cl2时:
①正极反应:_______________; ②负极反应:_______________;
③电池总反应:_______________; ④溶液pH的变化:_______________.
参考答案:(1)①3O2+12e-+6H2O=12OH-?②C2H4-12e-+16OH-=2CO32-+10H2O?
③C2H4+3O2+4OH-=2CO32-+4H2O? ④减小?
(2)①3Cl2+6e-=6Cl-?
?②2Al-6e-+6OH-=2Al(OH)3↓(或2Al-6e-+8OH-=2AlO2-+4H2O)?
③3Cl2+2Al+6OH-=2Al(OH)3↓+6Cl-(或3Cl2+2Al+8OH-=6Cl-+2AlO2-+4H2O)
④减小
本题解析:考查原电池中电极反应式的书写。
(1)原电池中正极得到电子,负极失去电子,所以乙烯在负极通入,氧气在正极通入。由于电解质是氢氧化钾,所以电极反应式分别是,正极:3O2+12e-+6H2O=12OH-;负极:C2H4-12e-+16OH-=2CO32-+10H2O 。正负极电极反应式合并即得到总反应式,即总反应式是C2H4+3O2+4OH-=2CO32-+4H2O;根据反应式可知,反应中消耗氢氧化钾,所以溶液的pH减小。
(2)金属铝失去电子,氯气得到电子,所以铝是负极,氯气在正极通入。由于电解质是氢氧化钾,所以电极反应式分别是,正极:3Cl2+6e-=6Cl-;负极:2Al-6e-+8OH-=2AlO2-+4H2O。正负极电极反应式合并即得到总反应式,即总反应式是3Cl2+2Al+8OH-=6Cl-+2AlO2-+4H2O;根据反应式可知,反应中消耗氢氧化钾,所以溶液的pH减小。
本题难度:一般
2、选择题 下列装置或操作能达到实验目的是( )
A.
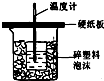
中和热测定
B.
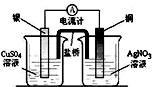
构成原电池
C.
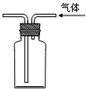
收集氢气
D.
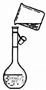
定容
参考答案:C
本题解析:
本题难度:简单
3、选择题 电子表中电源常用银—锌微型电池,电极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:Zn+2OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-?电池的总反应式为:Ag2O+Zn= 2Ag+ZnO,下列判断不正确的是
A.锌为负极,Ag2O为正极
B.锌发生还原反应,氧化银发生氧化反应
C.原电池工作时,负极附近溶液的pH值减小
D.原电池工作时,电子流动方向为Zn→Ag2O
参考答案:B
本题解析:由电池的总反应方程式可知:A.锌为负极,失去电子,被氧化;Ag2O为正极,得到电子,被还原。正确。B.锌作负极,发生氧化反应,氧化银得到电子,发生还原反应。错误。C.在原电池工作时,负极由于不断消耗OH-,所以附近溶液的c(OH-)减小,pH值减小。正确。D.原电池工作时,电子从电池的负极流向电池的正极。即流动方向为Zn→Ag2O。正确。
本题难度:一般
4、填空题 科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事目的。一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。
回答下列问题:
(1)这种电池放电时发生的化学反应方程式是____。
(2)此电池的正极发生的电极反应式是____;负极发生的电极反应式是____。
(3)电解液中的H+离子向____极移动;向外电路释放电子的电极是____。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化效率高,其次是___。
参考答案:(1) 2CH3OH+3O2==2CO2+4H2O
(2) 3O2+12H++12e-== 6H2O; 2CH3OH+2H2O-12e-==2CO2+12H+
(3)正; 负极
(4)燃料电池减少了对空气的污染
本题解析:
本题难度:一般
5、选择题 在原电池和电解池的电极上所发生的反应,属于氧化反应的是( )
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
参考答案:原电池负极上失电子发生氧化反应,正极上得电子发生还原反应;电解池中,阳极上失电子发生氧化反应,阴极上得电子发生还原反应,
故选C.
本题解析:
本题难度:一般