1、选择题 下列除去杂质(试样中括号内的物质是杂质)时,选用的试剂正确的是
?
| A
| B
| C
| D
|
试样
| KNO3(NaCl)
| CO2(CO)
| Fe(A1)
| SiO2(CaCO3)
|
除杂试剂
| AgNO3溶液
| O2
| NaOH溶液
| 硫酸
|
?
参考答案:C
本题解析:略
本题难度:简单
2、选择题 下列分离方法不正确的是( )
A.用饱和碳酸钠溶液除去二氧化碳气体中的氯化氢气体
B.在混有少量铁粉的铜粉中,加入足量的稀HCl,充分反应后过滤,再用水洗涤沉淀,可以得到铜粉
C.将KCl和MnO2的混和物,放入足量水中溶解、过滤,可以将混和物初步分离
D.根据密度不同,可以用淘洗的方法从沙子里得到黄金
参考答案:A.二氧化碳和氯化氢都能与饱和碳酸钠溶液反应,除去二氧化碳中混有的氯化氢气体,应用饱和碳酸氢钠洗气,故A错误;
B.铁粉能与稀HCl反应而铜不能,过滤后能得到较纯净的铜,故B正确;
C.KCl可溶于水,MnO2不溶于水,可用过滤分离,故C正确;
D.淘洗是依靠金和沙子的密度不同而进行分离,在淘洗过程中,较轻的沙子易被水流带走,而留下较重的金,故D正确.
故选A.
本题解析:
本题难度:一般
3、选择题 下列各组混合物中,可以用分液漏斗进行分离的是( )
A.乙酸和乙醇
B.葡萄糖和水
C.酒精和水
D.苯和水
参考答案:A、乙酸和乙醇是互溶的,不能用分液漏斗分离,故A错误;
B、葡萄糖和水是互溶的,不能用分液漏斗分离,故B错误;
C、乙醇和水是互溶的,不能用分液漏斗分离,故C错误;
D、苯和水是互不相溶的两层液体,可以用分液漏斗分离,故D正确.
故选D.
本题解析:
本题难度:一般
4、选择题 在相同条件下,A容器中的O2和B容器中的NH3所含的原子总数相等,则两个容器的体积比为
A.1∶2
B.1∶3
C.2∶3
D.2∶1
参考答案:D
本题解析:
本题难度:一般
5、实验题 (10分)欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol/L的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
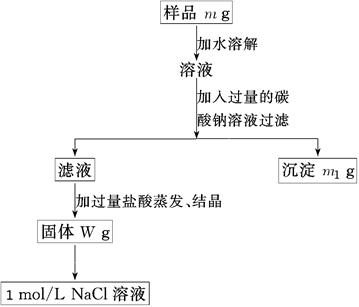
⑴称量粗盐样品m g,样品放在托盘天平左盘上。
⑵过滤时,需用到的玻璃仪器除烧杯、玻璃棒外有?。
⑶蒸发操作时应将液体放在___?___中加热,等加热至____?____时即停止加热。
⑷在样品的溶液中加入过量的Na2CO3溶液,作用是____________________________,反应的离子方程式是___?___________________。
⑸在滤液中加入盐酸的作用是________?________,发生反应的化学方程式是____?_______。
⑹配制100 mL 1mol/L的NaCl溶液时,应从W g固体中称取NaCl的质量为____________。
参考答案:(10分,每空1分,方程式各2分) (2)漏斗? (3)蒸发皿 剩余较少液体
(4)使钙离子完全形成沉淀而除去 Ca2++CO32—-===CaCO3↓
(5)除去过量的Na2CO3 ?Na2CO3+2HCl===2NaCl+H2O+CO2↑
(6)5.9 g
本题解析:(2)过滤时,需用到的玻璃仪器除烧杯、玻璃棒外有漏斗。
(3)蒸发操作时应将液体放在蒸发皿中加热,等加热至剩余较少液体时即停止加热。
(4)氯化钠中含有氯化钙,所以在样品的溶液中加入过量的Na2CO3溶液的作用是使钙离子完全形成沉淀而除去,反应的离子方程式是Ca2++CO32—-===CaCO3↓。
(5)由于碳酸钠是过量的,所以在滤液中加入盐酸的作用是除去过量的Na2CO3,有关反应的化学方程式是Na2CO3+2HCl===2NaCl+H2O+CO2↑。
(6)100 mL 1mol/L的NaCl溶液只溶质的质量是0.1L×0.1mol/L×58.5g/mol=5.85g。由于托盘天平只能读数到0.1g,所以实际称量的质量是5.9g。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以本部分内容主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般