1、选择题 某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是?
A.石蕊
B.硝酸银
C.氢氧化钠
D.氯化铝
参考答案:D
本题解析:试题分析:自来水一般用氯气消毒,所以自来水具有弱酸性和强氧化性,因此选项A、B、C都是会发生变化的,而氯化铝不会发生变化,答案选D。
考点:考查氯水的性质
点评:氯气溶于水即得到氯水,氯水中存在H+、OH-、Cl-、ClO-、Cl2、HClO、H2O,据此可以判断氯水参与反应时所起的作用。
本题难度:简单
2、选择题 200℃时,11.6?g?CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6g,则原混合物的平均式量为
A.5.8
B.11.6
C.23.2
D.46.4
参考答案:C
本题解析:设CO2和H2O的物质的量分别是x和y,则根据反应的方程式2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑可知,28x+2y=3.6g。又因为44x+18y=11.6g,所以16x+16y=11.6g-3.6g=8.0g。因此x+y=0.5mol,所以原混合物的平均式量为11.6÷(x+y)=23.2,答案选C。
本题难度:简单
3、选择题 a molNa2O2和b molNaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出O2和H2O的物质的量为1:1时,a:b为
A.1:1
B.1:2
C.2:3
D.2:1
参考答案:C
本题解析:分析:混合物在密闭容器中加热到250℃时,可能发生如下反应:
①2NaHCO3 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑
②2Na2O2+2CO2=2Na2CO3+O2
③2Na2O2+2H2O=4NaOH+O2
④2NaOH+CO2=Na2CO3+H2O?
由上述反应,可得总的反应方程式为:
Ⅰ、Na2O2+2NaHCO3 2Na2CO3+
2Na2CO3+ O2↑+H2O↑
O2↑+H2O↑
Ⅱ、2Na2O2+2NaHCO3 2Na2CO3+O2↑+2NaOH?
2Na2CO3+O2↑+2NaOH?
当排出O2和H2O的物质的量为1:1时,只能发生反应Ⅰ、Ⅱ,根据方程式计算解答.
解答:混合物在密闭容器中加热到250℃时,可能发生如下反应:
①2NaHCO3 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑
②2Na2O2+2CO2=2Na2CO3+O2
③2Na2O2+2H2O=4NaOH+O2
④2NaOH+CO2=Na2CO3+H2O?
由上述反应,可得总的反应方程式为:
Ⅰ、Na2O2+2NaHCO3 2Na2CO3+
2Na2CO3+ O2↑+H2O↑
O2↑+H2O↑
Ⅱ、2Na2O2+2NaHCO3 2Na2CO3+O2↑+2NaOH?
2Na2CO3+O2↑+2NaOH?
当排出O2和H2O的物质的量为1:1时,只能发生反应Ⅰ、Ⅱ,
Ⅰ×2+Ⅱ可得:4Na2O2+6NaHCO3 6Na2CO3+2O2↑+2NaOH+2H2O↑?
6Na2CO3+2O2↑+2NaOH+2H2O↑?
故n(Na2O2):n(NaHCO3)=4:6=2:3,
故选C.
点评:本题考查混合物的有关计算、钠的化合物的性质等,难度较大,注意利用方程式叠加讨论剩余固体、排出的气体发生的反应情况.
本题难度:简单
4、选择题 KCl、KBr的混合物3.87g溶于水中,加入过量的AgNO3溶液,充分反应后,得到沉淀6.63g,则原混合物中钾元素的质量分数为
A.0.241
B.0.259
C.0.403
D.0.487
参考答案:C
本题解析:分析:发生反应KCl、KBr转化为AgCl、AgBr,由于银离子代替钾离子导致质量增大,由电荷守恒可知n(K+)=n(Ag+),结合质量差计算n(K+),再根据m=nM计算m(K+),再根据质量分数的定义计算.
解答:发生反应KCl、KBr转化为AgCl、AgBr,由于银离子代替钾离子导致质量增大,由电荷守恒可知n(K+)=n(Ag+),则108g/mol×n(K+)-39g/mol×n(K+)=6.63g-3.87g,解得n(K+)=0.04mol,
故原混合物中钾元素的质量分数=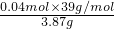 ×100%=40.3%,
×100%=40.3%,
故选C.
点评:本题考查混合物的有关计算,难度中等,注意根据反应分析质量变化的原因,注意电荷守恒利用判断n(K+)=n(Ag+)是解题的关键,比较过程法更简单.
本题难度:简单
5、选择题 “绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想原子经济性反应是原料分子中的原子全部转化成所需要的产物,实现零排放。下列反应类型一定符合这一要求的是
①取代反应?②加成反应?③消去反应?④水解反应?⑤加聚反应?⑥氧化反应?
A.①④
B.②③
C.⑤⑥
D.②⑤
参考答案:D
本题解析:试题分析:加成反应和加聚反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,原子利用率高达100%,
故选D。
考点:取代反应与加成反应 绿色化学 消去反应与水解反应 聚合反应与酯化反应
点评:题考查学生有机反应类型的特点,要求学生熟记教材知识,学以致用。
本题难度:简单