1、计算题 (4分)硝酸铜受热易分解:2Cu(NO3)2 ?2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO
?2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO  2Cu2O+ O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2
2Cu2O+ O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2 N2O4,2NO2=2NO+O2等反应)。
N2O4,2NO2=2NO+O2等反应)。
现取5.64gCu(NO3)2无水晶体,在一定温度下使其分解,将生成的气体及时导出并用足量的NaOH溶液充分吸收。
⑴若该质量的无水硝酸铜经加热完全分解,其中的铜元素全部转化为氧化铜,则氧化铜的质量是__________g。
⑵若该质量的无水硝酸铜完全分解,铜元素全部转化为氧化亚铜,反应过程中生成的气体被足量的NaOH溶液充分吸收后,还有多余的气体,则多余的气体是________(填分子式),其体积(标准状况)是_____________L。
⑶若该质量的无水硝酸铜分解后的残留固体中含有1.60g CuO,则残留固体的质量可能
是_________g。
参考答案:(1)2.4g(1分);⑵O2,0.168L(各1分,共2分);⑶3.48g或2.32g(共1分);
本题解析:(1)5.64gCu(NO3)2的物质的量是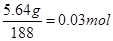 ,所以可以生成0.03mol氧化铜,质量是0.03mol×80g/mol=2.4g。
,所以可以生成0.03mol氧化铜,质量是0.03mol×80g/mol=2.4g。
(2)如果生成氧化亚铜,则方程式为4Cu(NO3)2 ?2Cu2O+8NO2↑+3O2↑.生成的气体溶于水发生反应的方程式为4NO2+O2+来源:91考试网 91ExAm.org2H2O=4HNO3,所以氧气是过量的。0.03mol硝酸铜生成0.06molNO2和0.0225mol氧气,所以通入水后剩余氧气是0.0225mol-0.015mol=0.0075mol,标准状况下的体积是0.168L。
?2Cu2O+8NO2↑+3O2↑.生成的气体溶于水发生反应的方程式为4NO2+O2+来源:91考试网 91ExAm.org2H2O=4HNO3,所以氧气是过量的。0.03mol硝酸铜生成0.06molNO2和0.0225mol氧气,所以通入水后剩余氧气是0.0225mol-0.015mol=0.0075mol,标准状况下的体积是0.168L。
(3)1.60g CuO是0.02mol。如果残留物是氧化铜和氧化亚铜构成的,则氧化亚铜的质量是0.005mol×144g/mol=0.72g,则总质量是2.32g;如果是氧化铜和硝酸铜构成的,则硝酸铜是0.01mol,质量是1.88g,则总质量是3.48g。
本题难度:一般
2、简答题 某同学用10mol/L的浓盐酸配制250mL?1mol/L的稀盐酸,并进行有关实验.请回答下列问题:
(1)需要量取浓盐酸______mL.
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______、______等.
(3)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为______g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为______.
参考答案:(1)设浓盐酸的体积为V,则10mol×V=1mol/L×0.25L,V=0.025L=25mL,故答案为:25;
(2)用胶头滴管定容,用250mL容量瓶配制溶液,故答案为:胶头滴管;250mL容量瓶;
(3)盐酸和锌反应的方程式为:Zn+2HCl=ZnCl2+H2↑,设参加反应的锌的质量为x,参加反应的盐酸的物质的量为y.
? Zn+2HCl=ZnCl2+H2↑
65g?2mol?22.4L
x?y?0.896L
x=0.896L×65g22.4L=2.6g
y=2mol×0.896L22.4L=0.08mol,
剩余盐酸的物质的量=1mol/L×0.1l-0.08mol=0.02mol,
则氢离子浓度=0.02mol0.1L=0.2mol/L,
故答案为:2.6;0.2mol/L.
本题解析:
本题难度:一般
3、选择题 标准状况下有①0.112 L水?②3.01×1023个氯化氢分子?③13.6 g H2S气体?④0.2 mol氨气,下列对这四种物质的关系由小到大排列正确的是?(?)
A.体积:①④③②
B.密度:④①②③
C.质量:①④③②
D.氢原子数:①③④②
参考答案:A
本题解析:略
本题难度:简单
4、选择题 下列各溶液中,Na+浓度最大的是
A.5 L 1.2 mol·L-1的Na2SO4溶液
B.2 L 0.8 mol·L-1的NaOH溶液
C.1 L 1 mol·L-1的Na2CO3溶液
D.4 L 0.5 mol·L-1的NaCl溶液