1、选择题 下列气体由于能结合血红蛋白而引起中毒的是.
①NO2? ②CO? ③H2S? ④SO2? ⑤Cl2? ⑥NO
A.②⑥
B.①②③④⑥
C.②③⑤
D.②③
参考答案:A
本题解析:题目给出的几种气体,都是大气的重要污染物,而NO、CO都易与血液里的血红蛋白结合,致使血红蛋白失去输送氧气的能力,造成人体缺氧而死亡.
本题难度:简单
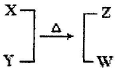
2、填空题 (12分)X、Y、Z、W为电子数相同的分子或离子。X有5个原子核。通常状况下,W为无色液体。它们之间转化关系如图所示,请回答:
(1)工业上每制取1molZ要放出46.2 kJ的热量,写出该反应的热化学方程式:???。
(2)实验室制取Z的方法不止一种,写出其中一种方法的化学方程式:???。
(3)某化学小组同学模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。
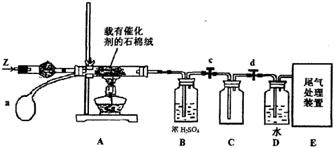
①A中发生反应的化学方程式是???。
②B中浓H2SO4的作用是???。
(4)写出D装置中反应的化学方程式???。
(5)向含有ag HNO3的稀溶液中,加入bg铁粉充分反应,铁粉全部溶解。已知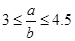 ,则被还原的HNO3的质量为???g。
,则被还原的HNO3的质量为???g。
参考答案:(1)N2(g)+3H2(g)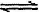 2NH3(g)?△H="-92.4" kJ/mol
2NH3(g)?△H="-92.4" kJ/mol
(2)2NH4Cl+Ca(OH)2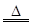 2NH3↑+2H2O+CaCl2或NH3·H2O
2NH3↑+2H2O+CaCl2或NH3·H2O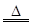 NH3↑+H2O
NH3↑+H2O
(3)①4NH3+5O2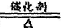 4NO+6H2O?②吸收H2O(g)和未反应的NH3
4NO+6H2O?②吸收H2O(g)和未反应的NH3
(4)3NO2+H2O=2HNO3+NO?(5)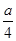
本题解析:W为无色液体,一般是H2O,即有10个电子,X有5个原子核且有10个电子,可推断出是NH4+,则Y为OH-,Z为NH3。
(1)工业上合成氨,是用氢气和氮气直接合成,反应方程式为N2(g)+3H2(g)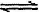 2NH3(g)?△H="-92.4" kJ/mol
2NH3(g)?△H="-92.4" kJ/mol
(2)氨的实验室制法,一般是加热铵盐和碱的混合物。
(3)(4)氨经过一系列反应可以得到硝酸,其过程可表示为N2 —NH3—NO—NO2—HNO3。
(5)当铁不足时,此反应的方程式为
4HNO3+Fe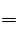 Fe(NO3)3+NO+2H2O
Fe(NO3)3+NO+2H2O
4? 1
b/14? b/56
则(b/14)=(a/63)?得a/b=4.5
当铁过量时,剩余的铁能继续和Fe(NO3)3反应,该反应方程式为
8HNO3+3Fe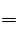 3Fe(NO3)2+2NO+4H2O
3Fe(NO3)2+2NO+4H2O
8? 3
b/56? b/21
则 b/21=(a/63)?得a/b=3
又因为(a/b)大于等于3,小于等于4.5,说明该反应介于刚才所列举的两者之间,即反应方程式为
4Fe+12HNO3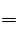 3Fe(NO3)2+Fe(NO3)3+3NO+6H2O
3Fe(NO3)2+Fe(NO3)3+3NO+6H2O
12? 3
a? a/4
即被还原的硝酸的质量为(a/4)g。
点评:本题通过推断,判断出N元素的相关物质,主要考察书上关于NH3及HNO3的制法的化学方程式,学生可以根据所学知识进行解答,难度不大。
本题难度:一般
3、选择题 关于硝酸的性质,下列说法不正确的是?
A.稀硝酸与Zn反应生成H2
B.浓硝酸与C反应生成CO2
C.Cu与稀硝酸、浓硝酸都能发生反应
D.常温下,Fe在浓硝酸中发生钝化
参考答案:A
本题解析:略
本题难度:简单
4、选择题 为除去镀在铝表面的铜镀层,可选用的试剂是( )
A.稀HNO3
B.浓HNO3
C.浓H2SO4
D.浓HCl
参考答案:B
本题解析:稀HNO3与铜和铝都能反应;浓HNO3只与铜反应,与Al常温下发生钝化,内层Al不再反应,故可用浓HNO3除去铜镀层;浓H2SO4常温下与铜不反应,加热条件下与铜、铝均反应;浓HCl与铜不反应不能除去铜镀层。
本题难度:一般
5、计算题 (10分) 硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低。现有一定量的铁粉和铝粉混合物与一定量很稀的硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入1 mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。(提示:氢氧化铝不溶于弱酸弱碱,只溶于强酸强碱)

(9)?铁与极稀的硝酸发生反应时得还原产物可能是____________;该反应的化学方程式为______________________________________________________________。
(10)B的数值是:______________mol。
(11)C的数值是:______________mL。
参考答案:(10分) (1) NH4NO3(1分)? 8Fe + 30 HNO3 = 8Fe(NO3)3 + 3NH4NO3 + 5H2O(3分)
(2) 8 (3分)
(3分)
(3) 7(3分)
本题解析:略
本题难度:简单