1、选择题 将下列物质用铂丝蘸取溶液做焰色反应火焰为黄色的是( )
A.NaOH
B.K2SO4
C.MgCl2
D.FeSO4
参考答案:A
本题解析:
本题难度:简单
2、简答题 我省有着丰富的天然气资源,许多化肥厂用天然气在高温、催化剂作用下与水蒸气反应来制备氢气和一氧化碳:CH4+H2O?
CO+3H2.为了证实该反应所生成的混合气体的成分,兴趣小组的同学设计了如下图所示装置并进行实验,请你回答下列相关问题:
(实验目的)证实混合气体中含有CO和H2
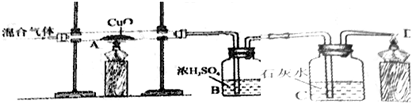
(进行实验)在装置中通入混合气体,点燃酒精灯,如上图所示进行实验
(实验分析) (1)若要证实混合气体中有CO,应该观察到的现象是______,相关的化学反应方程式是______、______.
(2)若要证实混合气体中有H2,且是通过装置B验证的,应采用的方法是______.
(3)有同学认为,根据该混合气体生产的实际情况,混合气体中可能含有水分,因而还应对上述实验装置加以改进.请你提出改进的方案______.
参考答案:(1)由于一氧化碳具有还原性,能使氧化铜变成铜,并生成二氧化碳,所以现象是黑色氧化铜变成红色,石灰水变浑浊,方程式有两个:一氧化碳还原氧化铜生成铜和二氧化碳CO+CuO?△?.?Cu+CO2,二氧化碳与石灰水反应生成碳酸钙和水CO2+Ca(OH)2=CaCO3↓+H2O.
故答案为:石灰水变浑浊,A中黑色粉末变为红色;CO+CuO?△?.?Cu+CO2;CO2+Ca(OH)2=CaCO3↓+H2O.
(2)由于氢气还原氧化铜生成了铜和水,浓硫酸具有吸水性,浓硫酸质量的增加量就是生成水的质量.
故答案为:称量反应前后装置B的质量并进行比较.
(3)在A装置前放一除水装置(例如用浓硫酸).
故答案为:在装置A前增加除水份装置.
本题解析:
本题难度:一般
3、选择题 某无色溶液中含有K+,Cl-,OH-,S
,S,为了检验除OH-外的其他所有阴离子,拟用盐酸、硝酸、硝酸银溶液、氢氧化钡溶液、溴水和酚酞六种试剂,设计如下实验步骤,并记录相关现象:
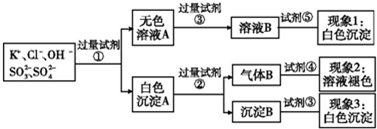
下列有关结论错误的是( )
A.试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl
B.现象3中白色沉淀是BaSO4
C.产生现象2的离子方程式是:Br2+2H2O+SO2=4H++2Br-+S
D.试剂②是盐酸,试剂③是硝酸
参考答案:检验SO32-、SO42-和Cl-,先加入试剂分离氯离子与SO32-、SO42-,然后分别检验氯离子、亚硫酸根离子和氯离子,所以试剂①为Ba(NO3)2溶液,无色溶液为含有氢氧根离子和氯离子等混合液,加入硝酸银前必须将溶液中和,使用的是硝酸,注意不能够使用盐酸,所以试剂③为硝酸,试剂⑤为检验氯离子的硝酸银溶液;白色沉淀A为亚硫酸钡和亚硫酸钡的混合物,可以加入试剂②稀盐酸,亚硫酸钡沉淀溶液,生成了二氧化硫气体,再加入溴水具有生成的气体为二氧化硫;白色沉淀B不溶于盐酸和试剂③硝酸,所以B为硫酸钡,
A、试剂③用于排除其他能跟Ag+产生沉淀离子的干扰,使用的是硝酸溶液,不是硝酸银,故A错误;
B、根据以上分析可知,白色沉淀B为硫酸钡,故B正确;
C、二氧化硫与溴单质反应,导致溴水褪色,反应的方程式为:Br2+2H2O+SO2=4H++2Br-+SO42-,故C正确;
D、试剂②用于溶解亚硫酸钡,硝酸检验氧化性,能够氧化亚硫酸钡,不能够使用硝酸,选用盐酸,试剂③证明白色沉淀为硫酸钡,使用的是硝酸,故D正确;
故选A.
本题解析:
本题难度:简单
4、选择题 某无色溶液可能存在Al3+、H+、Na+、SO32-、CO32-、NO3-、AlO2-和S2-八种离子中的几种,进行如下实验:
①向溶液中加入足量的稀盐酸,产生无色气体;
②继续滴加BaCl2溶液,产生白色沉淀;
③过滤后,向滤液中逐滴加入NaOH溶液,产生白色沉淀;继续滴加,白色沉淀消失。
由此推断原溶液中
[? ]
A.一定存在的离子是Na+、SO32-、CO32-、AlO2-?
B.一定存在的离子是Na+、SO32-、NO3-?、AlO2-
C.可能存在的离子是Al3+、CO32-?
D.可能存在的离子是CO32-、S2-
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列实验操作或对实验事实的描述中不正确的有
[? ]
A.在做蒸馏实验时,温度计水银球放置于支管口附近
B.向某溶液中加入新制Cu(OH)2,加热出现红色沉淀,说明该溶液中一定含醛类物质
C.制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸
D.检验某卤代烃是否是氯代烃
参考答案:B
本题解析:
本题难度:一般