1、选择题 等物质的量的下列化合物在相应条件下完全分解后得到氧气最多的是( )
A.KClO3(加MnO2催化剂,加热)
B.KMnO4加热
C.H2O2(水溶液,加MnO2催化剂)
D.HgO(加热)
参考答案:A
本题解析:
本题难度:简单
2、填空题 按要求写出下列方程式:
(1)一种单质与一种盐发生反应的方程式:______
(2)小苏打电离的电离方程式:______
(3)碳酸钙与盐酸反应的离子方程式:______.
参考答案:(1)一种单质与一种盐发生反应可以是金属与盐的置换反应,如Fe+CuSO4=FeSO4+Cu,也可以是化合反应,如
Fe+2FeCl3=3FeCl2,或非金属与盐的置换反应,如Cl2+Na2S=2NaCl+S↓,故答案为:Fe+CuSO4=FeSO4+Cu(符合题意的都可以);
(2)小苏打为强电解质,在溶液中完全电离生成Na+和HCO3-,电离方程式为NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-;
(3)碳酸钙难溶于水,与盐酸反应生成氯化钙和二氧化碳气体,反应的离子方程式为CaCO3+2H+═Ca2++H2O+CO2↑,故答案为:CaCO3+2H+═Ca2++H2O+CO2↑.
本题解析:
本题难度:简单
3、选择题 下列化学用语正确的是
A.氯化氢的电子式 B.镁的原子结构示意图
B.镁的原子结构示意图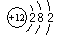
C.次氯酸的结构式? H-Cl-O
D.碳酸钠的电离方程式 Na2CO3=Na+ + CO32—
参考答案:B
本题解析:
 正确答案:B
正确答案:B
A、氯化氢的电子式?C、次氯酸的结构式? H-O-Cl;
D.碳酸钠的电离方程式 Na2CO3=2Na+ + CO32—
本题难度:一般
4、选择题 下列有关化学用语使用正确的是?
A.次氯酸的结构式: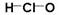
B.四氯化碳分子球棍模型: 
C.甲基的电子式: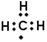
D.油酸的分子式:C18H32O2
参考答案:C
本题解析:次氯酸的结构式: ,故A错误;
,故A错误; 是四氯化碳分子比例模型,故B错误;C正确;油酸的分子式:C18H34O2,故D错误;故选C。
是四氯化碳分子比例模型,故B错误;C正确;油酸的分子式:C18H34O2,故D错误;故选C。
本题难度:一般
5、选择题 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成甲、乙两份。向甲中逐渐加入铜粉,最多能溶解9.6g铜粉。向乙中逐渐加入铁粉,最多能溶解14.0g铁粉。 (假设硝酸只被还原为NO气体)。下列分析或结果错误的是
A.原混合酸中NO3—物质的量为0.1 mol
B.乙中最多产生气体是0.2mol
C.原混合酸中HNO3浓度为1.0 mol·L-1
D.原混合酸中H2SO4浓度为2.5 mol·L-1