|
|
|
高中化学知识点总结《热化学方程式》试题预测(2020年最新版)(四)
2021-02-18 05:00:27
【 大 中 小】
|
1、填空题 (15分)研究碳及其化合物有重要意义。
(1)科学家用CO2和H2生产甲醇做燃料。
已知:甲醇的燃烧热ΔH= -726.5kJ/mol;氢气的燃烧热ΔH= -285.8kJ/mol;
则常温常压下,CO2(g)和H2(g)反应生成CH3OH(l)的热化学方程式 。
(2)460℃时,在4L密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2和CH3OH(g)的物质的量随时间的变化关系如图所示。
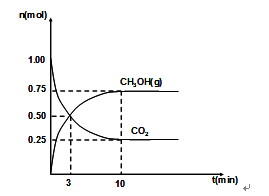
①从反应开始到3min时,H2O(g)的平均反应速率 ,
②下列措施中既能加快反应速率又能使H2的转化率增大的是 ,
A.使用更有效的催化剂
B.在原容器中再充入1mol CO2
C.在原容器中再充入1mol He
D.缩小容器的体积
| E、将甲醇及时分离出来
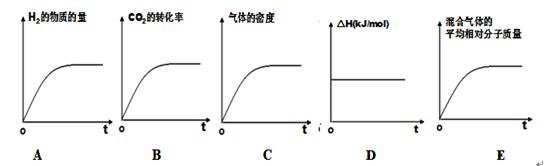
③若该反应的焓变为ΔH,则下列示意图正确且能说明反应达到平衡状态的是________。
④该条件下,此反应的化学平衡常数为 。
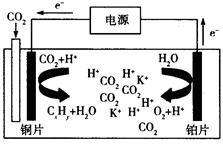
(3)科学家研究发现,还可以用电催化法将CO2还原为碳氢化合物。原理如下图所示(电解质溶液是一种钾盐)。若CxHy为C2H4,则该原理的总反应式为为: 。
(4)已知
化学式
| 电离平衡常数
| HCN
| K=4.9×10-10
| H2CO3
| K1=4.3×10-7、K2=5.6×10-11
|
①25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)=_________。
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:________________。
参考答案:(15分).
(1)CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=" -130.9" kJ/mol (2分)
(2)①0.042mol/(l·min) (1分) ,②BD (2分),③BE (2分),④36 (2分);
(3)2CO2+ 2H2O =C2H4+3O2(2分)
(4)①2.0×10-2(2分),②CN-+ CO2+ H2O ="HCN+" HCO3-(2分)
本题解析:(1)甲醇燃烧的热化学方程式是CH3OH(l)+3/2O2(g)= CO2(g)+ 2H2O(l) ΔH= -726.5kJ/mol,氢气燃烧的热化学方程式是H2(g)+1/2O2(g)= H2O(l) ΔH= -285.8kJ/mol,根据盖斯定律,将氧气消去,下式乘以3减去上式可得氢气与二氧化碳反应生成甲醇的热化学方程式,答案为CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=" -130.9" kJ/mol;
(2)①从反应开始到3min时,甲醇的物质的量增加0.50mol,则水蒸气的物质的量也增加0.50mol,所以H2O(g)的平均反应速率是0.50mol/4L/3min="0.042" mol/(l·min);
②A、使用催化剂,只能加快反应速率,不能改变平衡,所以氢气的转化率不变,错误;B、在原容器中再充入1mol CO2,则反应物的浓度增大,反应速率加快,同时平衡正向移动,则氢气的转化率增大,正确;C、在原容器中再充入1mol He,则容器的压强增大,但各物质的浓度不变,反应速率和平衡都不变,错误;D、缩小容器的体积,则压强增大,反应速率加快,同时平衡正向移动,氢气的转化率增大,正确,答案选BD;
③A、氢气的起始物质的量不是0,与题意不符,错误;B、二氧化碳的转化率逐渐增大,达到平衡时,不再增大,正确;C、因为是恒容条件,气体的密度始终不变,不能判断为平衡状态,错误;D、一个化学反应的反应热只与反应物与生成物的状态有关,所以反应热始终不变,错误;E、该反应是气体的物质的量发生变化的可逆反应,所以气体的平均相对分子质量也发生变化,达到平衡时,不再变化,正确,答案选BE;
④根据图像可知,平衡时甲醇的物质的量是0.75mol,二氧化碳的物质的量是0.25mol,则水蒸气的物质的量是0.75mol,氢气的物质的量是3.25-0.75×3=1mol,根据平衡常数的定义,则该条件下的平衡常数K=(0.75/4)2/(1/4))30.25/4=36;
(3)根据电子的移动方向可知,铜极为阴极,铂极为阳极,阴极是二氧化碳得到电子与氢离子结合为乙烯和水,阳极是水失去电子,生成氧气和氢离子,所以总反应是二氧化碳与水反应生成乙烯和氧气,化学方程式是2CO2+ 2H2O =C2H4+3O2;
(4)①因为HCN的电离常数K=4.9×10-10=c(H+) c(CN-)/ c(HCN),pH=11,则c(H+)=10-11mol/L,则c(HCN)/c(CN-)= c(H+)/K=2.0×10-2;
②向NaCN溶液中通入少量CO2,根据表中酸的电离常数可知,酸性:H2CO3>HCN>HCO3-,所以NaCN和碳酸氢钠,不会再生成碳酸钠和HCN,则反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,
考点:考查盖斯定律的应用,化学平衡状态的判断,化学平衡移动的应用,电离常数的应用
本题难度:困难
2、简答题 已知下列热化学方程式:
(1)C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
(2)2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1
(3)2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ?mol-1
请写出C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学方程式______.
参考答案:(1)C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
(2)2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ?mol-1
(3)2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ?mol-1
利用盖斯定律将(1)-(2)2-(3)2可得:
2C(s,石墨)+H2(g)=C2H2(g)△H=(-393.5kJ/mol)-2×(-571.6kJ/mol)-(-2599 kJ/mol)=+226.7kJ?mol-1,
所以热化学反应方程式为:2C(s,石墨)+H2(g)=C2H2(g);△H=+226.7kJ?mol-1
故答案为:2C(s,石墨)+H2(g)=C2H2(g);△H=+226.7kJ?mol-1.
本题解析:
本题难度:一般
3、填空题 尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)工业上合成尿素的反应如下:
2NH3(l)+CO2(g)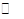 H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1 H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
下列措施中有利于提高尿素的生成速率的是
A.采用高温
B.采用高压
C.寻找更高效的催化剂
D.减小体系内CO2浓度
|
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)
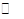
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4(l)
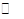
H2O(l)+H2NCONH2(l) △H2.
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和l mol二氧化碳,实验测得反应中各组分随时间的变化如下图I所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第
步反应决定,总反应进行到
min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上图II所示,则△H2
0(填“>” “<” 或 “=”)
(3)在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为
②已知:N2(g)+O2(g)=2NO(g).△H=180.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-1
则4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) △H=
kJ·mol-1
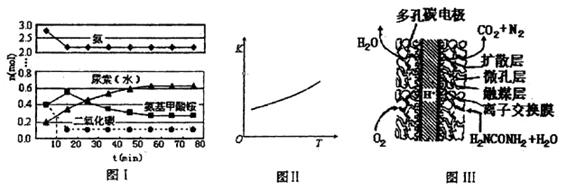
(4)尿素燃料电池结构如上图III所示。其工作时负极电极反应式
可表示为
。
参考答案:(1)A B C (2分)
(2)①2(2分); 55(2分)② >(2分)
(3)①CO(NH2)2+NO+NO2=CO2+2N2+2H2O(2分)
②
本题解析:
本题难度:困难
4、选择题 1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为( )
A.C + H2O ="=" CO + H2ΔH= +131.28kJ·mol-1
B.C(s)+ H2O(g) ="=" CO(g) + H2(g)ΔH= +10.94 kJ·mol-1
C.C(s)+ H2O(l) ="=" CO(g) + H2(g)ΔH= +131.28kJ·mol-1
D.C(s)+ H2O(g) ="=" CO(g) + H2(g)ΔH= +131.28kJ·mol-1
参考答案:D
本题解析:碳和水蒸气反应是吸热反应,所以△H大于0。根据题意可知1mol碳即12g碳吸热是10.94kJ×12=131.28kJ,因此选项D正确,A没有注明物质的状态,B中反应热不正确,C中水的状态不是气态,答案选D。
本题难度:一般
5、填空题 4克硫粉在氧气中完全燃烧时放出37千焦热量,该反应的热化学方程式是:_____________ 。
参考答案:“略”
本题解析:
本题难度:一般


 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1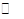 H2O(l)+H2NCONH2(l) △H2.
H2O(l)+H2NCONH2(l) △H2.