1、填空题 (6分)把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+ O2(g)=====CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g);ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)=====2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=====2H2O(g);ΔH4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量_________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________。
参考答案:(6分)(1)等于 (2)ΔH1=ΔH2+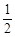 (ΔH3+ΔH4)
(ΔH3+ΔH4)
本题解析:(1)由盖斯定律可知,途径Ⅰ和途径Ⅱ反应物的状态和生成物的状态相同,焓变相同,反应热相同。(2)由盖斯定律得ΔH1=ΔH2+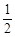 (ΔH3+ΔH4)。
(ΔH3+ΔH4)。
考点:焓变、盖斯定律
本题难度:一般
2、填空题 (8分)某同学从资料上查到以下反应
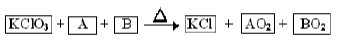
A、B为中学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体。回答下列问题:
(1)元素A、B可形成化合物AB2,则A元素的原子结构示意图为 ,AB2中的化学键是
(2)若反应中A和B的质量比为3:4,则n(KClO3):n(AO2)=
(3)已知: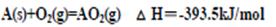

写出AB2(l)在O2中完全燃烧的热化学方程式为
参考答案:(8分)(每空2分)
(1) ,(极性)共价键 (2)1:1(3)AB2(l)+3O2 (g)=2BO2(g)+AO2(g) △H=-1076.8kJ/mol
,(极性)共价键 (2)1:1(3)AB2(l)+3O2 (g)=2BO2(g)+AO2(g) △H=-1076.8kJ/mol
本题解析:(1)能使澄清石灰水变浑浊的气体可能为CO2、SO2,元素A、B可形成化合物AB2,所以A为C元素、B为S元素,C的原子结构示意图为: ;CS2中化学键是(极性)共价键。
;CS2中化学键是(极性)共价键。
(2)反应中A和B的质量比为3:4,则C、S物质的量之比为2:1,依据原子守恒和化合价的变化,配平可得化学方程式:KClO3+2C+S=2KCl+2CO2+SO2,所以n(KClO3):n(CO2)=1:1。
(3)首先写出AB2(l)在O2中完全燃烧的化学方程式,并注明状态,AB2(l)+3O2 (g)=2BO2(g)+AO2(g),根据盖斯定律,该反应等效于①+2×②-③,可得?H=-1076.8kJ/mol,所以人化学方程式为:AB2(l)+3O2 (g)=2BO2(g)+AO2(g) △H=-1076.8kJ/mol。
考点:本题考查物质的推断、原子结构示意图、化学键、热化学方程式的书写。
本题难度:困难
3、选择题 根据热化学方程式:S(s)?+?O2(g)→?SO2(g)?+?297.23?kJ,下列说法正确的是
[? ]
A.1?mol?SO2(g)的能量总和大于1?mo?S(s)和1?mol?O2(g)的能量总和
B.1个硫分子与1个氧气分子反应生成2个二氧化硫气体分子放出297.23?kJ热量
C.S(g)?+?O2(g)?→?SO2(g)+?Q1?kJ;Q1的值大于297.23
D.S(g)?+?O2(g)?→?SO2(g)?+?Q1?kJ;Q1的值小于297.23
参考答案:C
本题解析:
本题难度:简单
4、选择题 对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)△H<0?的化学反应,下列叙述错误的是( ? )
A.反应过程中能量关系可用图表示
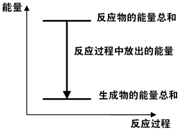
B.若将该反应设计成原电池则锌为负极
C.△H的值与反应方程式的化学计量数有关
D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
参考答案:D
本题解析:
本题难度:一般
5、填空题 (14分)运用化学反应原理分析解答以下问题
(1)已知: ①CO(g)+2H2(g)  CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)
CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)  CO2(g)+H2(g) △H3= -41 kJ·mol-l
CO2(g)+H2(g) △H3= -41 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3
 则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应
 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
a.体系压强保持不变 B.混合气体密度保持不变
c. CO和H2的物质的量保持不变 d.CO的消耗速度等于CO2的生成速率
(3)氨气溶于水得到氨水。在25℃下,将x mol.L-l的氨水与y mol.L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+)____c(Cl-)(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数 .
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2 = 2N2+6H2O,电解质溶液应显 (填“酸性”、“中性”、“碱性”),
写出正极的电极反应方程式 .
参考答案:(每空2分,共14分)
(1)-247KJ·mol-1 K12·K2·K3
(2)a·c
(3) = K=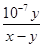 mol·L-1
mol·L-1
(4)碱性 O2+2H2O+4e-=4OH-
本题解析:(1)根据盖斯定律得3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H=①×2+②+③=△Hl×2+△H2+△H3=-247KJ·mol-1,平衡常数K= K12·K2·K3
CH3OCH3(g) +CO2(g) △H=①×2+②+③=△Hl×2+△H2+△H3=-247KJ·mol-1,平衡常数K= K12·K2·K3
(2)a、容器体积固定,3CO(g) +3H2(g) CH3OCH3(g) +CO2(g)是反应前后气体压强发生改变的可逆反应,所以体系压强保持不变时达平衡状态,正确;b、容器体积固定,根据质量守恒定律,得气体的密度始终不变,所以不能作为平衡状态到达的标志,错误;c、反应开始时,CO和H2的物质的量一直减少,当CO和H2的物质的量保持不变,不再减少时证明已达平衡状态,正确;d、CO的消耗速率任何状态都不等于CO2的生成速率,错误,答案选ac;
CH3OCH3(g) +CO2(g)是反应前后气体压强发生改变的可逆反应,所以体系压强保持不变时达平衡状态,正确;b、容器体积固定,根据质量守恒定律,得气体的密度始终不变,所以不能作为平衡状态到达的标志,错误;c、反应开始时,CO和H2的物质的量一直减少,当CO和H2的物质的量保持不变,不再减少时证明已达平衡状态,正确;d、CO的消耗速率任何状态都不等于CO2的生成速率,错误,答案选ac;
(3)根据电荷守恒定律,盐酸与氨水混合后的溶液显中性,则c(H+)=c(OH-),c(Cl-)+ c(OH-)=c(NH4+)+c(H+),所以c(Cl-)=c(NH4+);在25℃下,中性溶液中c(H+)= c(OH-)=1×10-7mol/L,若盐酸与氨水的浓度相等,则等体积混合后生成氯化铵溶液显酸性,而实际溶液显中性,说明氨水的浓度大于盐酸的浓度,氨水过量,设二者的体积均为1L,与盐酸反应完剩余氨水的物质的量(x-y)mol,一水合氨的浓度为(x-y)/2mol/L,c(NH4+)=c(Cl-)=y/2mol/L,则氨水的电离平衡常数K= c(OH-)c(NH4+)/ c(NH3·H2O)= 1×10-7mol/L×y/2mol/L/(x-y)/2mol/L=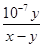 mol·L-1,
mol·L-1,
(4)根据电池反应式为:4NH3+3O2 =2N2+6H2O,判断氨气发生氧化反应,氧气发生还原反应,氨气失电子成为氮气和氢离子,所以电解质溶液应显碱性,产物中才能生成水;因为电解质溶液为碱性,所以正极是氧气的还原反应,氧气得电子与水结合生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-
考点:考查盖斯定律的应用 ,化学平衡状态的判断,化学平衡常数的计算,原电池反应原理的应用
本题难度:困难