|
|
|
高考化学知识点总结《难溶电解质的溶解平衡》在线测试(2020年最新版)(三)
2021-02-18 05:01:31
【 大 中 小】
|
1、选择题 Mg(OH)2在下列四种情况下,其溶解度最大的是
A.在纯水中
B.在0.1 mol·L-1的NH3·H2O溶液中
C.在0.1 mol·L-1的CH3COOH溶液中
D.在0.1 mol·L-1的MgCl2溶液中
|
2、选择题 已知下表数据
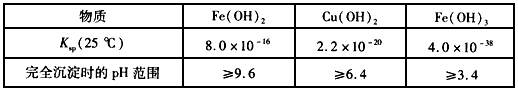
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是
[? ]
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C.向该溶液中加入适量氯水,并调节pH到3.4后过滤,可获得纯净的CuSO4溶液
D.在pH=5的溶液中Fe3+不能大量存在
3、选择题 Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12 ,已知,某溶液中含有C1-, Br- 和CrO42-,浓度均为0.010mo1·L-,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.C1-、Br-、CrO42-
B.CrO42-、Br-、C1-
C.Br-、C1-、CrO42-
D.Br-、CrO42-、C1-
|
4、选择题 下列关于难溶电解质溶液说法正确的是 ( )
A.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
B.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl-
D.25 ℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体后,c(Mg2+)增大
5、选择题 下列叙述和推论都正确的是
| 叙述
| 推论
|
A
| 酸性:HCl >H2CO3>H2SiO3
| 非金属性:Cl >C>Si
|
B
| 组成原电池时,通常是还原性较强的物质做负极
| 镁和铝在氢氧化钠溶液中组成原电池时,镁做负极
|
C
| —OH是亲水基,含有—OH的有机物都易溶于水
| 常温时,C2H5OH和 都易溶于水 都易溶于水
|
D
| 溶解度小的沉淀可转化成溶解
度更小的沉淀
| 向AgCl悬浊液中滴加KI溶液可以得到AgI沉淀
|
 都易溶于水
都易溶于水