1、选择题 向浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,溶液的颜色变化应该是
A.颜色变浅
B.变为红色
C.没有变化
D.变为棕黄色
参考答案:D
本题解析:Fe(NO3)2溶液中存在着具有还原性的Fe2+,同时有大量的NO3-,当加入稀盐酸时,溶液中相当于存在了具有强氧化性的稀硝酸,于是将Fe2+氧化成Fe3+.原Fe2+溶液为浅绿色,逐渐反应后将变为Fe3+溶液的颜色,即棕黄色.
本题难度:一般
2、选择题 下列化合物可以由两种单质直接化合而成的是
A.FeCl2
B.SO2
C.SO3
D.NO2
参考答案:B
本题解析:铁与氯气反应生成FeCl3,A选项错误.硫与氧气反应生成二氧化硫,B选项正确、C选项错误.氮气与氧气化合生成NO,D选项错误.
本题难度:简单
3、选择题 标准状况下有以下四种气体:①6.72L CH4②3.01×1023 HCl分子③13.6g H2S ④0.2mol NH3。下列对四种气体的关系从小到大表示不正确的是
A.物质的量:④<①<②<③
B.体积:④<①<③<②
C.质量:④<①<③<②
D.氢原子个数:②<④<③<①
参考答案:A
本题解析:①中甲烷物质的量为6.72L÷22.4L/mol=0.3mol,质量是0.3mol×16g/mol=4.8g,氢原子的物质的量是0.3mol×4=1.2mol。②HCl的物质的量是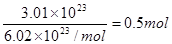 ,质量是0.5mol×36.5g/mol=18.25g,氢原子多的物质的量是0.5mol。③中H2S的物质的量是13.6g÷34g/mol=0.4mol,氢原子的物质的量是0.4mol×2=0.8mol。④中氨气的质量是0.2mol×17g/mol=3.4g,氢原子的物质的量是0.2mol×2=0.4mol。因为体积之比是物质的量之比,所以只有选项A是正确的,答案选A。
,质量是0.5mol×36.5g/mol=18.25g,氢原子多的物质的量是0.5mol。③中H2S的物质的量是13.6g÷34g/mol=0.4mol,氢原子的物质的量是0.4mol×2=0.8mol。④中氨气的质量是0.2mol×17g/mol=3.4g,氢原子的物质的量是0.2mol×2=0.4mol。因为体积之比是物质的量之比,所以只有选项A是正确的,答案选A。
本题难度:一般
4、选择题 将4.00 g Fe、Mg合金投入到足量的一定浓度的硝酸中,金属与硝酸完全反应,共收集到标准状况下的气体V L(HNO3被还原为NO和NO2);若向反应后的溶液中加入足量的氢氧化钠溶液,待金属元素全部沉淀后,再将沉淀过滤、洗净、干燥后称量其质量为8.25 g.则收集到的气体体积V值可为
A.1.12
B.5.34
C.7.26
D.8.23
参考答案:B
本题解析:设Fe、Mg的物质的量分别为x、y,则有:56 g/mol·x+24 g/mol·y=4.00 g,107 g/mol·x+58 g/mol·y=8.25 g,解得x=y=0.05 mol
失去的电子数为:n(e-)=0.25 mol
若全为NO2∶n(NO2)=0.25 mol,V(NO2)=5.6 L
若全为NO∶n(NO)=0.25/3 mol,V(NO)=1.87 L
故1.87<V<5.6,所以选B项有可能.
本题难度:一般
5、选择题 下列关于钠单质性质的叙述中不正确的是
A.因极易被氧化,必须保存在煤油中
B.有银白色金属光泽
C.能置换出CuCl2溶液中的Cu
D.在空气中燃烧火焰为黄色
参考答案:C
本题解析:分析:A、钠的化学性质活泼,密度比煤油密度大;
B、金属钠是具有金属光泽的金属;
C、金属钠和盐溶液反应的规律是先和溶液中的水之间发生反应;
D、金属钠在空气中燃烧生成产物是过氧化钠.
解答:A、钠的化学性质活泼,不易与空气接触,又密度比煤油密度大,所以用煤油保存,故A正确;
B、金属钠是具有银白色金属光泽的金属单质,故B正确;
C、金属钠和氯化铜中的水先发生反应生成氢氧化钠和氢气,然后生成的氢氧化钠和氯化铜发生反应生成氢氧化铜沉淀和氯化钠,不会置换出金属铜,故C错误;
D、金属钠在空气中燃烧发出黄色火焰,生成产物是淡黄色固体过氧化钠,故D正确.
故选C.
点评:本题考查学生过金属钠的性质,可以根据教材知识来回答,难度不大.
本题难度:困难