1、填空题 (三选一)【选修2:化学与技术】
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)目前,以下“技术”中,可用于“海水淡化”的是_________?(填序号)。
①蒸馏法?②膜分离法(电渗析、反渗透)?③冷冻法?④离子交换法
(2)海水晒盐利用的化学原理是________;分离食盐晶体后的母液中含有________,经过分离、提纯后,可用于___________。?
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应的离子方程式为_________;电解所用的食盐水需要精制,为什么?__________________;精制时所用试剂为:盐酸、BaCl2溶液、NaOH溶液、Na2CO3溶液。加入试剂时,Na2CO3溶液必须在加入________之后加入。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
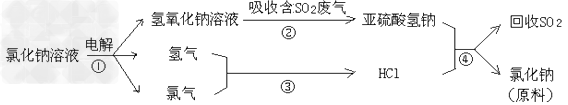
写出反应②的化学方程式_____________。
2、填空题 使用Cl2对自来水消毒时,会产生对人体有害的有机氯化物,而二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
(1)Cl2可以通过氯碱工业获得.氯碱工业中电解饱和食盐水的化学方程式为______,电解一段时间后,欲使溶液恢复到电解前的浓度和体积,可向电解后的溶液中加入(或通入)______.用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.除杂操作时,往粗盐水中先加入过量的______(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去.
(2)氯化钠电解法是一种可靠的工业生产ClO2的方法.该法工艺原理示意如图.其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2.氯化钠电解槽中发生反应的化学方程式为______,发生器中生成ClO2的化学方程式为______.

3、简答题 工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.
请回答下列问题:
电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许______(填离子符号,下同)通过,而不允许______和气体通过.电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、Mg2+、Fe3+、SO42-等杂质,因此必须精制.精制时所用试剂为①NaOH②Na2CO3③BaCl2④盐酸,这四种试剂的添加顺序为______ (填序号).
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.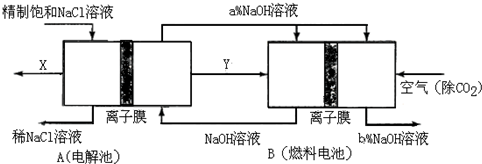
①图中X、Y分别是______、______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小______;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______;负极:______;
③这样设计的主要节(电)能之处在于(写出2处)______、______.
4、填空题 海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和金属镁的制备原料都来自于海水。
(I)在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如下图1所示) ⑴ 写出两极电极反应式,阳极_________,阴极_________________; ⑵ 图1中a和b分别是_______、_________; ⑶ 石棉隔膜的作用______。
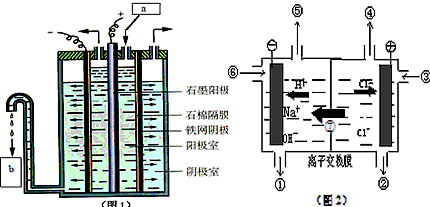
(II)随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高。20世纪80年代起,隔膜法电解工艺逐渐被离子膜电解技术取代。
⑴ 离子膜电解槽(如图2)中⑥⑦分别是_____、_____。
⑵ 已知一个电子的电量是1.602×10-19C,在离子膜电解饱和食盐水时通过电子1.929×105 C,则产生氯气____mol,氢气_____L(在标准状况下)_____NaOH g。
(III)下图是工业上生产镁的流程。
?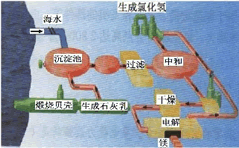
(1)写出下列反应的化学方程式:
①沉淀池中_________________________________;
②电解_____________________________________;
(2)整个生产流程中循环使用的物质是________。
(3)简述把氯化镁的水合晶体加热使之脱水转化为无水氯化镁的操作过程______________。?
5、填空题 氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水同时得到两种气体(一种是气体中密度最小的气体,一种是黄绿色气体)和一种易溶、易电离的碱。
(1)试写出电解食盐水的化学方程式:____________________________________;
(2)上述产物彼此之间或与其他物质可以发生在实际工业生产中有价值的反应。写出你能想到的有关反应的化学方程式:(只要求写出2个) ?
_________________________________________; ?
_________________________________________。