硝酸酸性太强不能用pH试纸检测
参考答案:C
本题解析:A. 乙烯气体可以使溴水褪色是因为发生了加成反应。错误。B.浓硫酸电导率比较低是因为在浓硫酸中硫酸主要以分子的形式存在,其中含有的自由移动的离子浓度较小。错误。C。氨气用于喷泉实验,是因为氨气在水中溶解度很大,氨气极易溶于水。1:700。当氨气在水中溶解,使烧瓶中的气体压强小于外界大气压强,水在大气压强的作用下,进入烧瓶,继续溶解氨气,再形成压强差。喷泉就此形成。正确。D.硝酸溶液使pH试纸先变红后变白,是因为硝酸有酸性,能够电离产生H+使pH试纸变红,但是由于硝酸有强氧化性,会把变红色的pH氧化为无色物质,因而又变为无色。错误。
本题难度:一般
2、选择题 造成光化学烟雾的有害气体主要是
A.CO2、碳氢化合物
B.NO和NO2
C.SO2
D.CO2
参考答案:B
本题解析:分析:CO2、碳氢化合物对大气的污染主要是形成温室效应;光化学烟雾的形成主要是汽车尾气排放出的氮氧化物发生复杂的变化造成的;二氧化硫气体是酸雨形成的主要原因.
解答:造成光化学烟雾的有害气体主要是汽车排放的尾气中的氮氧化物发生复杂的变化后形成的,故B正确.
点评:本题主要考查污染空气的几种效应和现象,重点了解引起污染的原因和物质.
本题难度:简单
3、选择题 强热FeSO4固体发生反应:2FeSO4  ?Fe2O3 + SO2↑+ SO3↑,若将此反应生成的气体通入BaCl2溶液中,则(?) ?Fe2O3 + SO2↑+ SO3↑,若将此反应生成的气体通入BaCl2溶液中,则(?)
A.析出BaSO3沉淀
B.析出BaSO4沉淀
C.逸出SO3气体
D.逸出SO2气体
参考答案:BD
本题解析:SO3+H2O= 2H++SO42—,而在强酸性的溶液中,Ba2+可生成BaSO4沉淀,而将SO2不能存在。
本题难度:一般
4、实验题 (14分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
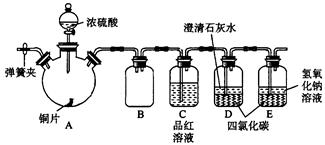
实验选用铜片、98.3%的H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜片一端没入浓H2SO4中,另一端露置在液面上方。
回答下列问题。
(1)Cu与浓H2SO4的反应的化学方程式为____________________。
(2)D、E两容器中CCl4的作用是____________________。
(3)加热过程中,观察到A容器中出现大量白色烟雾,随着反应的进行,A容器下有白色沉淀生成,你认为该沉淀物是_________,分析可能的原因是________________________________________。
(4)对A容器中的浓H2SO4和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是_________________________________________,设计实验验证你的猜想_______________________________________。
(5)实验结束后,为了减少环境污染,排除各装置中的SO2,可采取的操作是________________________________________________________。
参考答案:(1) Cu+2H2SO4(浓)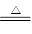 CuSO4+SO2↑+H2O(2分)?(2)防止倒吸(2分) CuSO4+SO2↑+H2O(2分)?(2)防止倒吸(2分)
(3)CuSO4(2分),浓硫酸中含水少,生成的硫酸铜较多,浓硫酸的吸水作用(2分)
(4)由于SO2溶解度较大,澄清石灰水中Ca(OH)2含量低,生成了Ca(HSO3)2溶液的缘故(2分);取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(2分)(或者加热、加盐酸检验SO2气体等方法)
(5)打开A容器上的弹簧夹,向里通入空气,将装置中的SO2赶到E中,最后再在B中加入NaOH溶液盖上塞子,振荡即可(2分)(注:直接在A中加NaOH溶液不给分)
本题解析:(1)浓硫酸具有强氧化性,和铜的反应的方程式是Cu+2H2SO4(浓)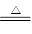 CuSO4+SO2↑+H2O。 CuSO4+SO2↑+H2O。
(2)由于SO2易溶于水,如果直接通入SO2,容易引起倒吸。而SO2不溶于四氯化碳,且四氯化碳不溶于水,密度大于水,所以四氯化碳的作用就是防止倒吸。
(3)由于浓硫酸中含有的溶剂水很少,而生成的硫酸铜较多,且浓硫酸具有吸水性,所以会有硫酸铜晶体析出。
(4)由于SO2溶解度较大,澄清石灰水中Ca(OH)2含量低,因此SO2是过量的,所以不能生成硫酸钙沉淀,而是生成了可溶性的Ca(HSO3)2,因此溶于不变混浊。由于Ca(HSO3)2能和强碱反应生成沉淀,据此可以鉴别。或者利用Ca(HSO3)2和盐酸反应生成SO2来检验。即取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或者加热、加盐酸检验SO2气体等方法)。
(5)由于装置中会残留没有挥发出的SO2,所以正确的做法是打开A容器上的弹簧夹,向里通入空气,将装置中的SO2赶到E中,最后再在B中加入NaOH溶液盖上塞子,振荡即可。
本题难度:一般
5、选择题 通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实解释正确的是(?)
?
| 现?象
| 解?释
| A
| 浓HNO3在光照条件下变黄
| 浓硝酸不稳定,分解产生NO2能溶于浓硝酸
| B
| KI淀粉溶液中通入Cl2,溶液变蓝
| Cl2能与淀粉发生显色反应
| C
| 某溶液中加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀生成
| 说明该溶液中含有SO42-
| D
| 向盐酸中加入浓硫酸时产生白雾
| 说明浓硫酸具有脱水性
参考答案:A
本题解析:浓硝酸不稳定,见光易分解。分解生成的NO2溶于硝酸,而呈黄色,A正确。氯气具有氧化性,把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,B不正确。C不正确,因为硝酸具有氧化性,如果溶液中含有SO32-,也被氧化生成硫酸钡沉淀。浓硫酸具有吸水性,同时溶于水放出大量的热,促使氯化氢挥发,D不正确。所以正确的答案是A。
本题难度:一般
|
|