1、选择题 工业上要冶炼金属钠,可使用的方法是(?)
A.电解法
B.加热分解法
C.还原剂加热法
D.铝热剂法
参考答案:A
本题解析:略
本题难度:简单
2、选择题 科学家致力于二氧化碳的组合转化技术研究,把过多的二氧化碳转化为有益于人类的物质,如将CO2和H2O以1∶4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式:CO2+4H2 (?)+2H2O
(?)+2H2O
若将二氧化碳与氢气混合,在一定条件下以1∶3的比例发生反应,生成某种重要的化工原料和水,该化工原料可能是(?)
A.烷烃
B.烯烃
C.炔烃
D.芳香烃
参考答案:CH4? B
本题解析:从原子守恒的角度去分析,1 mol CO2与4 mol H2反应时,生成了2 mol H2O,生成的另一种物质中必有1 mol C和4 mol H,由方程式的化学计量数可知,此物质必为CH4。同理可知,CO2与H2按物质的量之比1∶3混合,除生成水外,另一种物质的实验式为CH2,也只能为烯烃。?
本题难度:简单
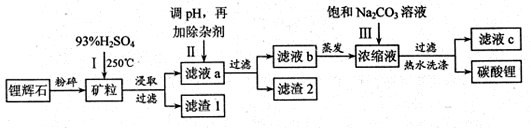
3、填空题 碳酸锂广泛应用于陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下:
已知①2LiAlSi2O6+H2SO4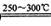 Li2SO4+Al2O3·4SiO2?H2O
Li2SO4+Al2O3·4SiO2?H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如下表

请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是?。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、 Mg2+ ?、Ca2+?、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的PH到6.0—6.5,此时沉淀的杂质离子有?;石灰石调节溶液PH的原理的离子方程式为?。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为?。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是?。
(5)从滤液c中可回收的主要物质是?。
参考答案:(1)增大锂辉石与硫酸的接触面积,加快浸出反应速率,提高浸出率
(2)Al3+、Fe3+?CaCO3+2H+=Ca2++H2O+CO2↑ (3)2Fe2++H2O2+2H+=2Fe3++2H2O,
(4)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失?(5)Na2SO4
本题解析:(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒可以扩大与硫酸的接触面积,加快浸出反应速率,提高浸出率。(2)在搅拌下加入石灰石以调节溶液的PH到6.0—6.5,此时因为Fe3+、Al3+完全形成氢氧化物沉淀时,溶液的PH分别为3.2、4.7,其它的PH值都大于 6.0—6.5。故此时沉淀的杂质离子有Al3+、Fe3+?。石灰石调节溶液PH的原理的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑。(3)加入双氧水能把亚铁离子氧化成铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,其它的反应都是复分解反应。(4)根据表格中碳酸锂的溶解度与温度的关系可知:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失。(5)由于它们发生了复分解反应。所以从滤液c中可回收的主要物质是Na2SO4。
本题难度:困难
4、选择题 下列关于海水资源的说法不正确的是(?)
A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
B.从海水中可以提取铀和重水等核原料
C.海水中的溴、氟等元素均为微量元素,但仍有提取的价值
D.海水中金的储存量约为陆地的170倍,但它的富集程度却很低
参考答案:C
本题解析:略
本题难度:简单
5、填空题 (10分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
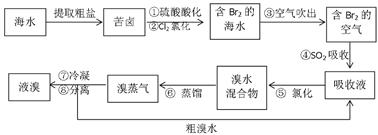
(1)溴在周期表中位于_________周期,_________族。
(2)步骤④的离子方程式:________________________________________?。
(3)步骤⑥的蒸馏过程中,溴出口温度为何要控制在80—90℃。温度过高或过低都不利于生产,请解释原因:___________________________________________?。
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。若在实验室分离上述混合物的分离仪器的名称是___________,分离时液溴从分离器的_________(填“上口”或“下口”)排出。
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:?。
参考答案:
(1)第四?ⅦA(2分)
(2)Br2+SO2+2H2O=4H++2Br―+ SO42―(2分)
(3)温度过高,大量水蒸气排出,溴气中水增加;
温度过低,溴不能完全蒸出,吸收率低。?(2分)
(4)分液漏斗?下口?(2分)
(5)氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高
“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程。(2分)
本题解析:略
本题难度:简单