1、选择题 在中学化学实验中使用的玻璃、陶瓷等仪器,在实验操作中不能承受温度的急剧变化,否则会引起安全事故。下列实验操作过程不是基于上述原因的是(?)
A.用排水法收集气体后,先移出导气管,后熄灭酒精灯
B.在用二氧化锰和浓盐酸制氯气时,在加入二氧化锰后应首先加入浓盐酸,然后再点燃酒精灯
C.在用固体氯化铵和氢氧化钙制取氨气结束后,将大试管从铁架台上取下置于石棉网上冷却后再洗涤
D.钠与水反应时,只能取黄豆粒大小的钠投入盛水的烧杯中反应
参考答案:D
本题解析:A、先移出导气管是为了避免液体倒吸进入装置,引起装置破裂,正确;B、若先加热再加入浓盐酸有可能引起温度骤变而试管破裂,正确;C、若大试管取下后直接洗涤会因温度骤降而破裂,正确;D、钠与水反应剧烈,若钠体积过大会因为反应过于剧烈而引起爆炸,错误。
本题难度:一般
2、选择题 从化学试剂商店购买的某些试剂瓶上常贴有危险化学品的标志。盛装氢氧化钠固体的试剂瓶上所贴的危险化学品标志是
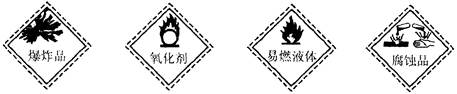
A? B? C? D
参考答案:D
本题解析:氢氧化钠是强碱,具有腐蚀性,选D。
本题难度:简单
3、实验题 为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究。
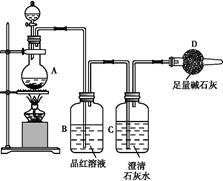
(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 ?。
(3)装置B的作用是 ?。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。装置A中能产生二氧化碳的化学方程式为 ?。
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。重新实验后观察到装置F中的现象是 ? 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定(5Fe2++Mn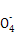 +8H+
+8H+ 5Fe3++Mn2++4H2O)。
5Fe3++Mn2++4H2O)。
测定铁元素质量分数的实验步骤如下:
Ⅰ.往烧瓶A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
Ⅱ.将滤液B稀释为250 mL;
Ⅲ.取稀释液25.00 mL,用浓度为c mol·L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 。?
②丙同学设计了下列滴定方式(夹持仪器省略),最合理的是 (填字母序号)。?
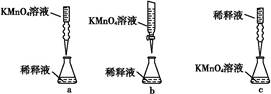
③滴定过程中 (填“需要”或“不需要”)加入指示剂。
④铁碳合金中铁元素的质量分数为 ?。
参考答案:(1)常温下碳与浓硫酸不反应
(2)铁、碳在酸溶液中形成原电池
(3)检验SO2的存在
(4)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(5)酸性KMnO4溶液或溴水(或其他合理答案) 品红溶液
品红溶液不褪色或无明显现象
(6)①250 mL容量瓶 ②b ③不需要 ④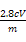 ×100%
×100%
本题解析:(1)合金中碳性质不活泼,在常温下与浓硫酸不发生反应;(2)反应一段时间后,浓硫酸变成稀硫酸,铁、碳和稀硫酸发生原电池反应;(3)装置B中品红溶液用于检验反应产物SO2;(4)碳与浓硫酸在加热条件下发生氧化还原反应,化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;(5)因为SO2也能使澄清石灰水变浑浊,所以甲同学结论错误,为了确认二氧化碳存在,必须排出SO2的干扰,E中盛放酸性高锰酸钾溶液,F中盛放品红溶液,品红溶液红色不褪色,证明SO2已不存在;(6)①稀释或配制一定体积溶液必须使用相应规格的容量瓶,②酸性KMnO4溶液和酸性稀释液应使用酸式滴定管,a、c均不正确,③酸性KMnO4溶液本身为紫红色,当滴入最后一滴半分钟内不褪色,即为终点,因此不需另用指示剂,④由滴定原理n(Fe2+)=5n(Mn
CO2↑+2SO2↑+2H2O;(5)因为SO2也能使澄清石灰水变浑浊,所以甲同学结论错误,为了确认二氧化碳存在,必须排出SO2的干扰,E中盛放酸性高锰酸钾溶液,F中盛放品红溶液,品红溶液红色不褪色,证明SO2已不存在;(6)①稀释或配制一定体积溶液必须使用相应规格的容量瓶,②酸性KMnO4溶液和酸性稀释液应使用酸式滴定管,a、c均不正确,③酸性KMnO4溶液本身为紫红色,当滴入最后一滴半分钟内不褪色,即为终点,因此不需另用指示剂,④由滴定原理n(Fe2+)=5n(Mn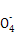 ),合金中铁的质量分数为w(Fe)=
),合金中铁的质量分数为w(Fe)=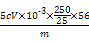 ×100%=
×100%=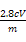 ×100%。
×100%。
本题难度:困难
4、选择题 对实验Ⅰ~Ⅳ的叙述正确的是
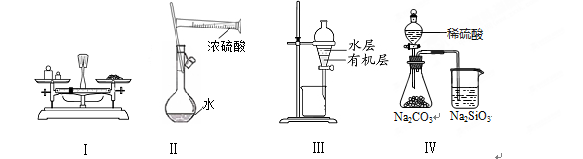
A.实验Ⅰ:用托盘天平称量一定质量的氯化钠固体
B.实验Ⅱ:配制一定物质的量浓度的硫酸
C.实验Ⅲ:用苯萃取溴水中的溴后进行分液
D.实验Ⅳ:比较硫酸、碳酸和硅酸酸性强弱
参考答案:D
本题解析:A、用托盘天平称量物质质量时,应该遵循左物右码,A不正确;B、浓硫酸不能在量筒中稀释,应该在烧杯中稀释,冷却后再转移到容量瓶中,B不正确;C、苯的密度比水小,有机层在上层,C不正确;D、稀硫酸与碳酸钠反应生成CO2。CO2通入到硅酸钠溶液中生成硅酸沉淀,据此可以比较硫酸、碳酸和硅酸酸性强弱,D正确,答案选D。
本题难度:一般
5、选择题 下列实验操作或原理不正确的是( )
A.纸层析法中的展开剂之所以能够展开的主要原理是毛细现象
B.分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒
C.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D.测定溶液pH的操作:将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较
参考答案:A、纸层析法依据极性相似相溶原理,是以滤纸纤维的结合水为固定相,而以有机溶剂作为流动相.由于样品中各物质分配系数不同,因而扩散速度不同,从而达到分离的目的,主要原理是毛细现象,故A正确;
B、为防止液体重新混合而污染,应将分液漏斗中的下层液体从下口放出,上层液体从上口倒出,故B正确;
C、萃取的原理是依据溶质在有机溶剂中的溶解度较大进行分离的操作,与密度无关,故C错误;
D、pH试纸不能直接插入到溶液中,使用时不能湿润,应将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较,故D正确.
故选C.
本题解析:
本题难度:简单