1、实验题 【化学——化学与技术】
1942年我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl
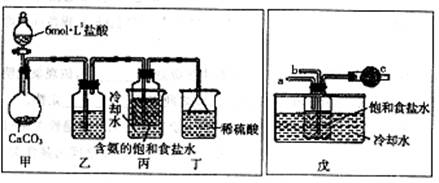
2NaHCO3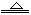 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是?(选填字母)。
a.高温? b.低温? c.常温? d.高压? e.低压? f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是?(选填字母)
a.碳酸氢钠难溶于水?
b.碳酸氢钠受热易分解?
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通人含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中央持、固定用的仪器未画出)。
实验结束后,分离出NaHCO3晶体的操作是?(填分离操作的名称)。
第二位同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入?气体,再从b管中通入?气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述):?。
参考答案:
(1)bd(2)c(3)过滤,氨气,CO2

本题解析:
(1)合成氨为气体物质的量减少的放热反应,高压、低温有利于提高氨的平衡浓度,从勒沙特列原理可以选择bd。
(2)根据复分解反应完成的条件可知,NaHCO3的溶解度较小,是析出碳酸氢钠晶体的主要原因,选c。
(3)固液分离操作用过滤操作。由于CO2的溶解度较小,因此通入CO2前,应先从a管通入氨气(防止NH3倒吸),因为氨气、H2O、CO2反应生成NH4HCO3,可以大大提高CO2的吸收,b管通入CO2有利于CO2的充分吸收。
(4)可以将过量的CO2通入NaOH溶液或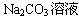 中。
中。
本题难度:简单
2、选择题 工业上用来合成氨的原料之一是氢气,有一种来源是取自石油气,有人设计了以下反应途径,假设反应都能进行,其中最合理的是
[? ]
A. C3H8 C+H2
C+H2
B. C3H8 C3H6+H2
C3H6+H2
C. C3H8+H2O CO+H2
CO+H2
D. C3H8+O2→CO2+H2O;H2O O2+H2
O2+H2
参考答案:C
本题解析:
本题难度:简单
3、填空题 (l)火法炼锌是将闪锌矿(主要成分是ZnS)通过浮选焙烧使它转化为氧化锌,再把氧化锌和焦?炭混合,在鼓风炉中加热到1100~1300℃,使锌蒸馏出来。
①写出火法炼锌的主要反应:
焙烧反应:?。
鼓风炉中可能发生的反应:?(任写一个)
②从保护环境和充分利用原料角度看如何处理和利用产生的烟气?
?
(2)工业上冶炼铝就是电解氧化铝
①冶炼铝的电解槽中的阴极和阳极材料均用石油炼制和煤的干馏产品?(填物质名称)
②氧化铝的熔点很高,在铝的冶炼中要加入冰晶石(Na3AlF),其作用是____?。
③工业上冶炼铝时用的原料是Al2O3,而不是AlCl3,其原因是?。
(3)工业上“联合制碱法”中主要反应的化学方程式是?。其中的CO2来源于?。
(4)磁酸钙是制玻璃的原料之一,工业上制玻璃是在玻璃熔炉中进行,其中反应之一为:
 ,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为?(用含a的代数式表示)。
,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为?(用含a的代数式表示)。
参考答案:(1)① 2ZnS+3O2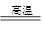 2ZnO+2SO2;2C+O2
2ZnO+2SO2;2C+O2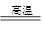 2CO或ZnO+CO
2CO或ZnO+CO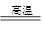 Zn+CO2或2ZnO+C
Zn+CO2或2ZnO+C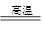 2Zn+CO2
2Zn+CO2
②用氨水吸收烟气中的SO2生成(NH4)2SO3或NH4HSO3,再让(NH4)2SO3或NH4HSO3与硫酸反应产生SO2,收集SO2用于生产硫酸。
(2)①石墨(或碳)②降低Al2O3熔化后温度,节约能量;③Al2O3熔化后能导电,AlCl3是共价化合物,熔化后不导电。
(3)NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl;2NaHCO3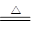 Na2CO3+CO2↑+H2O;合成氨厂。
Na2CO3+CO2↑+H2O;合成氨厂。
(4)22.4a
本题解析:(1)①根据题意“将闪锌矿(主要成分是ZnS)通过浮选焙烧使它转化为氧化锌”反应的化学方程式为2ZnS+3O2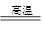 2ZnO+2SO2;根据题意“再把氧化锌和焦?炭混合,在鼓风炉中加热到1100~1300℃,使锌蒸馏出来”可能发生的反应就有:2C+O2
2ZnO+2SO2;根据题意“再把氧化锌和焦?炭混合,在鼓风炉中加热到1100~1300℃,使锌蒸馏出来”可能发生的反应就有:2C+O2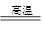 2CO或ZnO+CO
2CO或ZnO+CO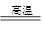 Zn+CO2或2ZnO+C
Zn+CO2或2ZnO+C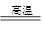 2Zn+CO2
2Zn+CO2
②分析题意,必须“从保护环境和充分利用原料角度”,而且
“如何处理和利用产生的烟气”,故用氨水吸收烟气中的SO2生成(NH4)2SO3或NH4HSO3,再让(NH4)2SO3或NH4HSO3与硫酸反应产生SO2,收集SO2用于生产硫酸。
(2)①电极材料是石墨碳棒;②电解氧化铝用冰晶石作为助熔剂,其目的是降低Al2O3熔化后温度,节约能量。③从本质上来分析,Al2O3是离子化合物,熔融时发生电离,而AlCl3是共价化合物,熔化后不导电。
(3)NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl;2NaHCO3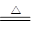 Na2CO3+CO2↑+H2O;合成氨厂。
Na2CO3+CO2↑+H2O;合成氨厂。
(4)CaCO3+SiO2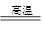 CaSiO3+CO2,据方程式可知CaCO3过量,应用SiO2计算生成CO2的量。
CaSiO3+CO2,据方程式可知CaCO3过量,应用SiO2计算生成CO2的量。
本题难度:一般
4、选择题 下列过程合乎实际并用于工业生产的是(?)
A.钠在氯气中燃烧制氯化钠
B.氯化铵与氢氧化钙共热制氨气
C.浓盐酸与二氧化锰共热制氯气
D.氯气与石灰乳反应制漂白粉
参考答案:D
本题解析:略
本题难度:简单
5、填空题 海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表的________族。
(2)目前,国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸气,蒸气经冷却而得高纯度的淡水。由此可判断蒸馏法是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:
NaCl+H2O NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下图:
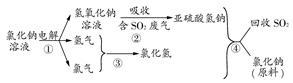
请写出②④的化学反应方程式:________、________。
参考答案:(1)ⅠA
(2)物理变化
(3) 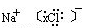 ?585
?585
(4)NaOH+SO2=NaHSO3? NaHSO3+HCl=NaCl+H2O+SO2↑
本题解析:(1)氯化钠中的金属元素为钠,它应位于元素周期表的ⅠA族。
(2)将海水蒸馏变成水蒸气属于物理变化。
(3)NaCl 的电子式为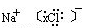 ,要制36.5%的浓盐酸1000 t所消耗的食盐应为
,要制36.5%的浓盐酸1000 t所消耗的食盐应为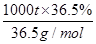 ×58.5 g/mol=585 t。
×58.5 g/mol=585 t。
(4)由图示给出的反应物和生成物不难写出②的反应方程式为NaOH+SO2=NaHSO3,④的反应方程式为NaHSO3+HCl=NaCl+H2O+SO2↑。
本题难度:一般