1、选择题 下列说法正确的是(?)
A.根据反应5Fe2++MnO4ˉ+8H+=5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4·7H2O)是否变质
B.根据反应3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O可知:反应中HNO3表现酸性和氧化性
C.根据反应CuSO4+H2S=CuS↓+H2SO4可知:H2S的酸性比H2SO4强
D.根据反应H3PO3+2NaOH(足量)=Na2HPO3+2H2O可知:H3PO3属于三元酸
参考答案:B
本题解析:酸性高锰酸钾溶液具有氧化性,能氧化亚铁离子,A不正确。B中有硝酸铁和NO生成,所以反应中HNO3表现酸性和氧化性,B正确。C不正确,硫化铜不溶于水,也不溶于酸,所以能够发生,但H2S的酸性比H2SO4弱。D不正确,反应中只消耗2mol氢氧化钠,应该是二元酸,答案选B。
本题难度:一般
2、填空题 (1)用“单线桥”表示下列反应电子转移的方向和数目:2KMnO4 + 16HCl=" 2KCl" + 2MnCl2 + 5Cl2↑+ 8H2O 反应中物质的氧化性:KMnO4_____ Cl2(填“>、<、=”);氧化产物与还原产物的物质的量之比为_____________。
(2)配平下列氧化还原反应方程式:___KMnO4+___H2S+__H2SO4(稀) —— __K2SO4+__MnSO4+__S↓+__H2O
(3)Cl2是一种黄绿色有毒气体,化工厂可用浓氨水来检验有毒气体Cl2是否泄漏,有关反应的化学方程式为:3Cl2+8NH3=6NH4Cl +N2若反应中NH3消耗6.8 g,则转移电子个数为?。
参考答案:(1)
 ? >? 5:2
? >? 5:2
(2)2 KMnO4+5H2S+3H2SO4(稀) ==?1K2SO4+2MnSO4+5S↓+8H2O
(3)0.3 NA或1.806×1023个
本题解析:(1)HCl失去10电子给KMO4,且KMnO4作氧化剂,氧化性大于HCl。氧化产物是Cl?2,还原产物是MnCl2。(2)利用电子得失相等和原子个数守恒,可以配平。(3)反应了6.8g的NH3,,实际发生氧化反应的0.1mol NH3,应转移0.3 NA个电子。
本题难度:一般
3、填空题 ⑴课本上叙述:“碳、硅、锗、锡的+4价化合物是稳定的.而铅的+2价化合物是稳定的。” 据此判断:锡的+2价化合物(如SnCl2)应具有较强的(填“氧化”或“还原”.下同)?性,铅的+4价化合物应具有较强的?性。PbO2与浓盐酸可发生氧化还原反应生成Cl2,该反应的化学方程式为?。
(2)我国古代炼丹中经常使用到红丹,俗称铅丹。在一定条件下铅丹(用X表示)与硝酸能发生如下反应:X+4HNO3 PbO2+2Pb(NO3)2+2H2O。铅丹的化学式是?,此铅丹中铅的化合价是?。由此反应可推测PbO是(填“酸”或“碱”)?性氧化物。
PbO2+2Pb(NO3)2+2H2O。铅丹的化学式是?,此铅丹中铅的化合价是?。由此反应可推测PbO是(填“酸”或“碱”)?性氧化物。
⑶砷酸钠在酸性条件下跟碘化钾溶液反应生成亚砷酸钠(Na3AsO3)、碘单质和水的离子反应方程式是?,上述反应中电子转移数目是?。
参考答案:、(1)还原、氧化? PbO2+4HCl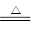 PbCl2+Cl2↑+2H2O?⑵ Pb3O4? +2,+4?碱
PbCl2+Cl2↑+2H2O?⑵ Pb3O4? +2,+4?碱
⑶AsO43- +2I- +2H+ ="==" AsO33- + I2↓ + H2O? 2
本题解析:(1)锡的+4价化合物是稳定的,因此锡的+2价化合物(如SnCl2)应具有较强的还原性;铅的+2价化合物是稳定的,所以铅的+4价化合物应具有较强的氧化性;PbO2与浓盐酸可发生氧化还原反应生成Cl2,则还原产物是PbCl2,所以方程式为PbO2+4HCl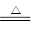 PbCl2+Cl2↑+2H2O。
PbCl2+Cl2↑+2H2O。
(2)生成物中+4价的铅和+2价的铅是1︰2的,所以X的化学式为Pb3O4,因此化合价分别是+2价和+4价。生成物有Pb(NO3)2,所以PbO是碱性氧化物。
(3)根据题意As的化合价从+5价降低到+3价,得到2个电子;碘的化合价从-1价升高到0价,失去1个电子,所以氧化剂和还原剂的物质的量之比是1︰2,则方程式为AsO43- +2I- +2H+ ="==" AsO33- + I2↓ + H2O,根据方程式可知,转移2个电子。
本题难度:一般
4、选择题 有关化学用语正确的是
①羟基的电子式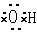 ?②乙烯的结构简式:CH2CH2
?②乙烯的结构简式:CH2CH2
③硫化氢的电子式 H+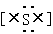 2-H+?④丙烷分子的球棍模型:
2-H+?④丙烷分子的球棍模型: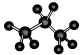
⑤苯分子的比例模型 ?⑥甲烷的结构式
?⑥甲烷的结构式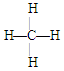
A.①④
B.②③④
C.④⑤⑥
D.②③⑤
参考答案:C
本题解析:①羟基的电子式,错误,氧原子应有一个单电子
②乙烯的结构简式,错误,碳碳双建不能省
③硫化氢的电子式,错误,硫化氢是共价化合物,不是离子化合物,没有阴阳离子
④丙烷分子的球棍模型,⑤苯分子的比例模型,⑥甲烷的结构式都正确,故选C
本题难度:一般
5、简答题 X、Y、Z、W四种化合物均由1~18号元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系如图1(部分反应物、产物及反应条件已略去).请回答:
(1)W的分子式是______.
(2)X与Y在溶液中反应的离子方程式是______.
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用图2装置快速制取少量的O2,并演示Na在O2中的燃烧实验.
①关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管.试判断装置是否漏气______?(填“漏气”、“不漏气”或“无法确定”),判断理由是______.
②写出A装置中反应的化学方程式并标出电子得失情况:______.
③C装置中观察到的现象是______.
④D装置中盛放的试剂是______,其作用是______.
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是______.
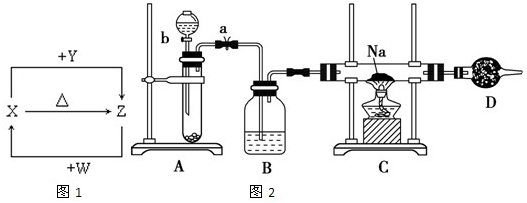
参考答案:(1)X、Y、Z的焰色反应均为黄色,说明三者均为钠元素的化合物.X含有四种元素,在加热条件下能生成Z,这四种化合物均为短周期元素组成,且W为无色无味的气体(中学阶段常见的无色无味的气体为H2、O2、CO2等),可推出X为NaHCO3,Y为NaOH,Z为Na2CO3,W为CO2.故答案为:CO2;
(2)X与Y在溶液中反应是NaHCO3+NaOH=Na2CO3+H2O,离子方程式是HCO3-+OH-=CO32-+H2O;故答案为:HCO3-+OH-=CO32-+H2O;
(3)X所含的四种元素为:Na、H、C、O,这四种元素组成的化合物有:NaHCO3、Na2CO3、NaOH、H2CO3、Na2O、Na2O2、NaOH、H2O、H2O2、CO2、CO等无机物和烃、烃的含氧衍生物等有机物;
①关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管,说明装置漏气,因为漏斗中的液体能全部流入试管,说明试管中压强与外界相同漏气;
故答案为:漏水;漏斗中的液体能全部流入试管说明试管中压强与外界相同;
②A装置中反应是过氧化钠和水的反应,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑反应的电子转移情况用双线桥标出电子得失情况为:
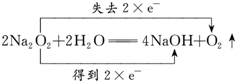
故答案为:
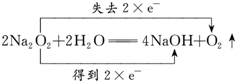
;
③C装置中观察到的现象是难在氧气中 燃烧的实验现象,钠剧烈燃烧,发出黄光,有淡黄色物质生成;故答案为:剧烈燃烧,发出黄光,有淡黄色物质生成;
④为避免空气中的二氧化碳和水蒸气进入C装置与钠反应,影响实验现象的判断,干燥管中应装碱石灰;故答案为:碱石灰;?防止空气中的H2O、CO2进入C装置;
(4)向Z(Na2CO3)溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质应为次氯酸钠,同时有X(NaHCO3)生成,依据原子守恒配平得到化学方程式为:2Na2CO3+Cl2+H2O=NaClO+NaCl+2NaHCO3;故答案为:2Na2CO3+Cl2+H2O=NaClO+NaCl+2NaHCO3;
本题解析:
本题难度:一般