1、选择题 下列生产和生活中常见的现象不属于氧化还原反应的是
[? ]
A.食品腐败
B.钢铁生锈
C.煤气燃烧
D.粗盐潮解
参考答案:D
本题解析:
试题分析:
选项A,食品腐败,主要是食物被氧化。
选项B,钢铁生锈是铁被氧化。
选项C,煤气燃烧是燃料被氧化。
选项D,粗盐潮解是物理变化。
故选:D
本题难度:简单
2、选择题 某溶液中含有SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是(? )
①反应前后,溶液中离子浓度基本保持不变的只有Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤共发生了2个氧化还原反应
A.①②③④⑤
B.①②③④
C.①③⑤
D.②④⑤
参考答案:B
本题解析:Cl2与发生水反应的离子方程式为:Cl2+H20 H++Cl-+HClO,具有酸性和强氧化性。Cl2通入到题中的溶液中后:
H++Cl-+HClO,具有酸性和强氧化性。Cl2通入到题中的溶液中后:
SO32-基本被氧化为SO42-,可能有一部分直接生成了SO2逸出溶液。氧化还原反应。
SiO32-因为溶液最终为酸性,转化为H2SiO3,胶状物质。
Br-被氧化为Br2,溶液变为橙色。氧化还原反应。
CO32-因为溶液最终为酸性,变成了CO2逸出溶液。
Na+不受影响。
算上Cl2溶于水发生歧化反应,共有3个氧化还原反应。
故选B。
点评:着重考查了氯水成分的多重性,每个性质发生一定的反应。由于氯水中成分的复杂性,使氯水具有下列多重性质:①氯水中有Cl2所以呈黄绿色,具有Cl2的强氧化性,如氯水能使润湿的KI淀粉试纸变蓝(用于对Cl2收集的验满),能与SO2、亚硫酸及其盐、FeBr2等发生氧化还原反应。②新制的氯水中有HClO,HClO具有强氧化性,故氯水具有漂白性。③因氯水中有HCl,所以氯水能与镁粉反应放出氢气,能与Na2CO3、CaCO3等反应产生CO2,能与硝酸银反应生成白色沉淀。④具有次氯酸的弱酸性。⑤氯水性质多重性同时表现:如,a.HCl的酸性与HClO的漂白性同时表现,所以新制氯水可使石蕊试液先变红后褪色。b.向氯水中加入NaOH溶液时,HCl和HClO分别同时与NaOH反应,生成NaCl、NaClO,反应为:Cl2+2NaOH==NaCl+NaClO+H2O⑥氯水中有大量H2O,加入无水CuSO4将会出现蓝色。
本题难度:简单
3、选择题 下列工业生产过程中,不涉及氧化还原反应的是
A.用S制备H2SO4
B.炼铁时用CaO除去原料中的SiO2
C.将海水中的MgSO4转变为金属Mg
D.用NO2生产HNO3
参考答案:B
本题解析:氧化还原反应的特征是化合价的升降,即凡是有元素化合价升降的反应都是氧化还原反应。氧化钙和二氧化硅反应属于化合反应,化合价没有变化,是非氧化还原反应。答案选B。
本题难度:简单
4、选择题 已知M2O7x一+3S 2一+14H+ ====2M3++3S↓+7H2O,则M2O7x一中的M的化合价为
A.+2
B.+3
C.+4
D.+6
参考答案:D
本题解析:该反应是离子反应型的氧化还原反应,可以根据电荷守恒计算,可以得到式子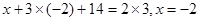 ,x=-2,则M2O72-,假设M的化合价为y,则有
,x=-2,则M2O72-,假设M的化合价为y,则有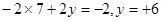 ,所以答案选D。
,所以答案选D。
本题难度:简单
5、选择题 铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C Pb+CO;PbO+CO
Pb+CO;PbO+CO Pb+CO2。
Pb+CO2。
下列说法正确的是(?)
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1molPb共转移2mol电子
D.将1molPbS冶炼成Pb理论上至少需要6g碳
参考答案:D
本题解析:富集方铅矿过程中没有新物质的生成,所以不属于化学变化,A错误;根据反应2PbS+3O2 2PbO+2SO2可知:PbS中S的化合价升高,所以PbS是还原剂,O的化合价降低,所以PbO和SO2都是还原产物,B错误;整个过程中生成2molPb,共转移12mol电子,所以生成1molPb转移6mol电子,C错误。1molPbS反应能生成1mol PbO,1mol PbO被还原需要至少需要C和CO 0.5mol,所以至少需要6g碳,D正确。答案选D。
2PbO+2SO2可知:PbS中S的化合价升高,所以PbS是还原剂,O的化合价降低,所以PbO和SO2都是还原产物,B错误;整个过程中生成2molPb,共转移12mol电子,所以生成1molPb转移6mol电子,C错误。1molPbS反应能生成1mol PbO,1mol PbO被还原需要至少需要C和CO 0.5mol,所以至少需要6g碳,D正确。答案选D。
点评:本题主要根据氧化还原反应的基本概念判断。
本题难度:一般