1、选择题
方案1 :向废液中加入过量的铁粉,充分反应后,过滤。?在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜。
方案1中涉及的四种阳离子的氧化牲由强到弱的顺序为:_____________________过滤操作时,需要用到的玻璃仪器是:______________________
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜作______极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_______________________________________________________?另一电极所发生的电极反应为_____________________________?方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为: ______________________
参考答案:①方案1:Fe3+>Cu2+>H+>Fe2+?漏斗、烧杯、玻璃棒方案2:阴? 2Fe3++2e-=2Fe2+;? Cu2++2e-="Cu" ;2H++2e-=H2↑;? 2Cl--2e-=Cl2↑有污染性气体Cl2产生?②使用了电解装置,成本较高等。
本题解析:本题以废液中回收Cu为素材,将氧化还原反应知识和电化学知识紧密的结合起来,方案1中同时考查了过滤操作。方案2是用电解的方法回收Cu,用铜和石墨作电极,铜要做阴极,阳离子在阴极得电子,因溶液中含有Fe3+、Cu2+、H+、Fe2+,所以存在得电子顺序问题,由方案1中知氧化性由强到弱的顺序为Fe3+>Cu2+>H+>Fe2+,故得电子顺序为Fe3+>Cu2+>H+>Fe2+,由题意知Fe3+、Cu2+、H+分别先后在阴极得电子。最后一问还从环保和经济方面考查了方案的不足。
本题难度:一般
2、填空题 (12分)FeCl3溶液棕黄色,对此溶液,分别做如下实验,请填表:
编号
| 实践操作
| 实验主要现象
| 离子方程式
|
①
| 加入过量
铁粉
| ?
| ?
|
②
| 加入少量Na2O2粉末
| ?
| ?
|
③
| 加入少量AgNO3溶液
| ?
| ?
参考答案:
编号
实验操作
实验主要现象
离子方程式
?
?
铁粉部分溶解,溶液有棕黄色变浅绿色
2Fe3++Fe=3Fe2+
?
?
生成红褐色沉淀并放出无色无味气体
2Na2O2+2H2O=4Na++4OH-+O2↑
Fe3++3OH—=Fe(OH)3↓
?
?
生成白色沉淀
Ag++Cl-=AgCl↓
本题解析:氯化铁溶液呈黄色,向其中加入过量铁粉生成氯化亚铁溶液,溶液呈浅绿色,离子方程式为2Fe3++Fe=3Fe2+。
过氧化钠与水生成氢氧化钠和氧气,氢氧化钠与氯化铁生成红褐色沉淀,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑、Fe3++3OH—=Fe(OH)3↓。
氯化铁与硝酸银生成白色沉淀,离子方程式为Ag++Cl-=AgCl↓。
点评:向溶液中加过氧化钠时,可认为过氧化钠先与水反应,生成的氢氧化钠再与溶液中溶质反应。
本题难度:一般
3、选择题 下列对于硫酸、硝酸的认识,正确的是(?)
A.浓硫酸和浓硝酸都具有氧化性
B.铜和浓硫酸的反应属于置换反应
C.在铜和浓硝酸的反应中,硝酸只发挥了氧化性,没有体现酸性
D.可用铝或铁制容器盛装稀硝酸
参考答案:A
本题解析:(中难)考查对硫酸、硝酸的化学性质的理解,浓硫酸和浓硝酸都是强氧化性酸,其强氧化性表现在+6价的S元素、+5价的N元素易得电子上。铜与浓硫酸反应的化学方程式为:2H2SO4(浓) + CuCuSO4 + 2H2O + SO2↑,显然不是置换反应。在硝酸参与的反应中,如果硝酸中的N元素的化合价降低则表现了它的强氧化性;如果硝酸中的N元素并没有完全被还原,在反应产物中还有NO3-保留下来,则硝酸既表现了氧化性,又体现了酸性。铜与浓硝酸反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,可看出硝酸既表现了氧化性,又体现了酸性。在常温下,浓硫酸和浓硝酸能使铁、铝等金属钝化,在金属表面上形成一层致密的氧化膜。但铁、铝在常温下就能与稀硝酸反应,所以不能用铝或铁制容器盛装稀硝酸。
本题难度:一般
4、选择题 某研究小组开展课外研究发现,将适量Zn与一定浓度氯化铁溶液反应,开始可以观察到大量气泡产生。反应后期,溶液的pH升高到6左右,金属表面出现黑色粉末,溶液变成浅绿色。试管底部出现灰绿色悬浮物。收集少量黑色粉末与稀硫酸作用有气泡产生。则下列反应没有发生的是( )
A.FeCl3+3H2O= Fe(OH)3↓+3HCl
B.Zn+2HCl=ZnCl2+H2↑
C.3Zn+2FeCl3=3ZnCl2+2Fe
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
参考答案:A
本题解析:FeCl3水解使溶液显示酸性,但是水解程度微弱,不会生成沉淀,A错误。
本题难度:一般
5、实验题 为测定 FeO 和 Fe2O3 固体混合物中 Fe元素的含量,可用氢气还原一定质量的此混合物并测定生成水的质量的方法来完成。若在实验室中选用下列实验装置来实现上述目的(图中夹持装置已略去,部分装置可重复使用)。请填空:
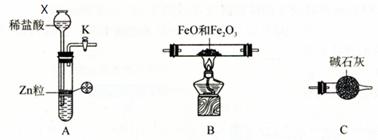
⑴仪器X的名称是?。
⑵写出A中发生反应的离子方程式?,
实验前如何检验装置A的气密性?。
⑶下图所示装置中与A装置具有相同作用的是?(填装置编号)。
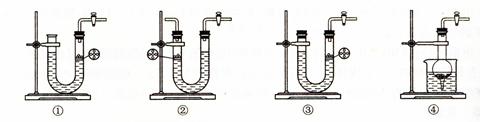
⑷按正确的实验设计,所连接的装置顺序为:A→C→?→?→?。
⑸若FeO和Fe2O3混合物的质量为 ag,反应完全后生成水的质量为 b g,则混合物中Fe元素的质量分数为?(用含字母的数学式表示)。
参考答案:(12分)⑴长颈漏斗。⑵Zn +2H+ = Zn2+ + H2↑,?
关闭活塞K,向长颈漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气。
⑶①④?⑷B→C→C。?⑸(1-8b/9a)×100%(或1-8b/9a)(其他合理答案也可。)
本题解析:(1)根据X的结构可知,X是长颈漏斗。
(2)A装置是制取氢气的,所以方程式为Zn +2H+ = Zn2+ + H2↑。由于A装置中是长颈漏斗,所以检验气密性的正确方法是关闭活塞K,向长颈漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气。
(3)A装置是简易启普发生器,当关闭K后,产生的气体使固体和液体分离,从而反应停止。所以选项①④正确。
(4)由于生成的氢气中会混有氯化氢和水蒸气,所以应该先除杂和干燥。由于要测量反应中生成的水蒸气,且还要防止空气中的水蒸气进入,因此正确的连接顺序是A→C→B→C→C。
(5)bg水中氧元素的质量是8b/9,所以混合物中铁元素的质量是(a-8b/9)g,因此铁元素的质量分数是(1-8b/9a)×100%(或1-8b/9a)。
本题难度:一般
|