1、选择题 在密闭容器中盛有H2、O2、Cl2混合气体,通过电火花引燃,气体恰好完全反应,冷却至室温后,所得液体产物中HCl的质量分数为25.62%,则容器中原有H2、O2、Cl2分子个数比为(?)
A.6∶3∶2
B.9∶6∶1
C.10∶6∶1
D.13∶6∶1
参考答案:D
本题解析:设有100 g溶液,则其中HCl:25.62 g即0.705 mol。
含H2O:74.38 g即4.13 mol,故n(Cl2)=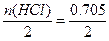 mol,n(O2)=
mol,n(O2)=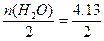 mol,n(H2)=
mol,n(H2)=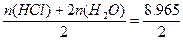 mol。
mol。
故n(H2)∶n(O2)∶n(Cl2)=13∶6∶1。
本题难度:简单
2、选择题 下列物质中,不能使干燥的有色布条褪色的是(?)
A.Cl2
B.氯水
C.漂白粉溶液
D.Na2O2溶于水得到的溶液
参考答案:A
本题解析:干燥的Cl2没有漂白性,所以选A。氯水中含有次氯酸、漂白粉溶液含有次氯酸钙、Na2O2溶于水得到的溶液中含有双氧水等都有漂白成分,会使干燥布条褪色。
点评:熟悉次氯酸、次氯酸盐、过氧化钠、过氧化氢等物质的漂白性
本题难度:一般
3、计算题 实验室可用如下反应制取氯气,反应原理如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑?+ 8H2O
(1)用单线桥表示出上述反应中电子转移的方向和数目
(2)上述反应中氧化剂与还原剂的物质的量比?
(3)15.8g KMnO4能使多少克HCl被氧化?
(4)产生的Cl2在标准状况下的体积为多少?(
参考答案:(1)单线桥略
(2)1:5
(3)被氧化的HCl:18.25g
(4)5.6L
本题解析:略
本题难度:简单
4、填空题 有一瓶无色干燥的混合气体,可能由HCl、NO、NO2、CO2、NH3、H2、O2、Cl2中的几种混合而成,根据下列实验现象:
①把混合气体通过浓硫酸时,气体体积明显减小;②再通过碱石灰时,体积又明显减小;③剩余气体接触空气时,立即变为红棕色.则:
(1)混合气体中一定存在 ?,
(2)一定不存在 ?,
(3)可能存在 ?。
参考答案:(1)NH3? CO2 ?NO?(2) NO2? Cl2? HCl? O2?(3)H2(每空2分)
本题解析:气体无色,表明不含NO2、Cl2气体;把混合气体通过浓硫酸时,气体体积明显减小,表明一定含有NH3,因为含有氨气,所以一定不含有氯化氢;再通过碱石灰时,体积又明显减小,一定含有CO2,剩余气体接触空气时,立即变为红棕色,表明气体中一定含有NO,一定不含有O2。H2的有无无法确定。
本题难度:一般
5、选择题 下列说法正确的是( )
A.氯水和过氧化钠都具有漂白作用,其漂白原理相似
B.硅和二氧化硅都是重要的半导体材料
C.蛋白质和油脂的水解都是由高分子化合物生成小分子化合物的过程
D.MgO和Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼镁、铝金属
参考答案:A
本题解析:
正确答案:A
A、正确,氯水和过氧化钠都具有强氧化性;
B. 不正确,硅是重要的半导体材料,SiO2是光导纤维的原料;
C. 不正确,蛋白质水解是由高分子化合物生成小分子化合物的过程,油脂是小分子化合物。
D. 不正确,MgO和Al2O3在工业上用于制作耐高温材料,Al2O3用于电解法冶炼铝,但用电解MgCl2炼镁。
本题难度:一般