1、选择题 下列反应中,反应物总能量低于生成物总能量的是(?)
A.C + CO2=2CO
B.C + O2=CO2
C.2C + O2= 2CO
D.C + CuO=CO2 + Cu
参考答案:A
本题解析:反应物总能量低于生成物总能量,反应吸热。选项B、C是燃烧反应,放热;选项D,碳粉与氧化铜的反应虽然需要高温的条件,但是该反应有气体放出,所以该反应还是可以进行的。故答案为A。
点评:考查化学反应与能量,熟记常见反应的吸热与放热即可。
本题难度:简单
2、选择题 已知:①H+(aq)+OH-(aq)=H2O(l);ΔH1;②2SO2(g)+O2(g) 2SO3(g);ΔH2。其他条件不变时,增加反应物的量,则下列判断正确的是( ? )
2SO3(g);ΔH2。其他条件不变时,增加反应物的量,则下列判断正确的是( ? )
A.ΔH1增大,ΔH2减小
B.ΔH1增大,ΔH2增大
C.ΔH1减小,ΔH2减小
D.ΔH1不变,ΔH2不变
参考答案:D
本题解析:化学反应的焓变与热化学方程式的计量数成正比,与实际参加反应的物质的用量无关,所以增加反应物的用量,两反应的焓变均不变。故选D
本题难度:一般
3、选择题 下列各表述与示意图一致的是


A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g) 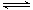 2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH<0使用和未使用催化剂时,反应过程中的能量变化
参考答案:B
本题解析:根据图象中纵横坐标的含义,利用点、线来分析一个量发生变化随另外一个量如何变化,若变化趋势与图象中变化趋势一致,即为正确答案。A、0.1mol?L-1NaOH溶液的pH为13,用0.1mol?L-1盐酸滴定恰好中和时pH为7,由于浓度相同,则体积相同。但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错误;B、由于反应为放热反应,则升高温度,平衡逆向移动。所以平衡后升高温度K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系,故B正确;C、由于反应中生成的Mn2+对该反应能起催化剂的作用,从而使反应速率加快,因此与图像不符,C不正确;D、由于该反应是放热反应,所以反应物的总能量高于生成物的总能量,但图象描述的反应物的总能量低于生成物的总能量,因此D错误,答案选B。
本题难度:一般
4、选择题 下列说法正确的是(?)
A.反应热就是反应中放出的热量
B.放热反应的△H>0,吸热反应的△H<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,△H为“—”
D.一个化学反应中,生成物的总键能大于反应物的总键能时,反应吸热,△H为“+”
参考答案:C
本题解析:A、反应热就是反应中放出的或者吸收的热量,错误;B、放热反应的△H<0,吸热反应的△H>0,错误;C、一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,△H为“—”,正确;D、一个化学反应中,生成物的总键能大于反应物的总键能时,反应放热,△H为“—”,错误。
本题难度:一般
5、选择题 化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是(?)
A.中和热的热化学方程式2KOH(aq)+ H2SO4(aq)= K2SO4(aq)+2H2O(l)ΔH= -57.3 kJ/mo1
B.氢气燃烧热的热化学方程式:
C.H218O2中加入H2SO4酸化的KMnO4:5H2 18O2 + 2MnO4-+ 6H+ = 518O2↑+ 2Mn2+ + 8H2O
D.向CH2BrCOOH中加入足量的NaOH溶液并加热:CH2BrCOOH+OH- △———→CH2BrCOO-+ H2O
参考答案:C
本题解析:中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以选项A不正确,应该是KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+2H2O(l)? ΔH= -57.3 kJ/mo1;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以选项B不正确,应该是H2 (g)+1/2O2 (g)=H2O(l)?△H=-241.8 kJ/mol;高锰酸钾能氧化双氧水,C正确;D不正确,在氢氧化钠溶液中加热,溴原子也能被羟基代替,发生水解反应,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重对学生基础知识的巩固与训练,有利于提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般