1、选择题 A元素原子核电荷数为11,B元素原子的质子数为8,A和B可形成化合物Z,下列说法中错误的是
A.A形成 +1价阳离子
B.Z一定能与水反应
C.Z中只能含有离子键
D.Z的熔点较高
参考答案:C
本题解析:A为钠、B为氧、Z为Na2O 、Na2O2;可见Z为离子化合物,熔点较高,均可与水反应。Na2O2除含有离子键外还有非极性共价键
本题难度:简单
2、计算题 已知某主族金属元素X的原子核内质子数和中子数之比为1:1,含该金属阳离子0.192g的溶液恰好能将20mL0.4mol/L的Na2CO3溶液中的CO32-全部沉淀,推断X是什么元素及在周期表中的位置。
参考答案:X为镁,位于第3周期第ⅡA族
本题解析:周期表中质子数与中子数相等的金属元素只有Mg和Ca两种,它们都是+2价金属。设金属的相对原子质量为M,由关系式 X2+~Na2CO3得:M:1=0.192:(0.4×0.02),解得M=24。则X为镁,位于第3周期第ⅡA族。
本题难度:简单
3、填空题 (4分)A.B.C是三种互不同族也不同周期的短周期元素,原子序数总和为26,它们可以结成一种三原子化合物,这种化合物的化学式是________。
参考答案:HClO(4分)
本题解析:“不同周期”,则三者分别在3个周期,那么一定有H(在第一周期),另两个会分别在2、3周期,
在第2周期的元素原子序数介于3到10之间,在第3周期的元素原子序数介于11到18之间,再利用“两者的原子序数总和为25”,即可求解;
本题难度:一般
4、填空题 (4分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)元素b的基态原子电子排布式为 。
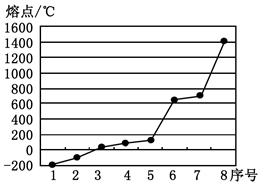
(2)第三周期8种元素按单质熔点高低的排列顺序如右图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号)。
(3)元素a、c分别与元素d形成的化合物中,熔点较高的是(填化学式)。
参考答案:(1)1s22s22p63s2(1分)(2)Si(1分)2(1分)(3)SiCl4(1分)
本题解析:(1)根据元素在周期表中的位置可知,b是镁元素,基态原子电子排布式为1s22s22p63s2。
(2)根据图像可知8表示的电子熔点最高,应该是原子晶体硅。同周期自左向右非金属性逐渐增强,电负性逐渐增大,所以电负性最大的是氯元素。在8种单质中氯气的熔点仅比Ar高,所以应该是2。
(3)元素a、c分别与元素d形成的化合物是四氯化碳和四氯化硅,二者均是分子晶体,其中熔点较高的是四氯化硅。
本题难度:一般
5、选择题 下列各组内液体混合物均可用分液漏斗分离的是
A.酒精和水、酒精和乙醚、乙酸乙酯和乙酸
B.溴乙烷和水、乙苯和水、乙酸乙酯和饱和Na2CO3溶液
C.四氯化碳和水、溴苯和水、甘油和水
D.石炭酸和苯、溴苯和苯、乙醛和水
参考答案:B
本题解析:
本题难度:困难