|
高中化学知识点大全《物质的组成》高频考点巩固(2020年模拟版)(八)
2021-02-18 05:59:40
【 大 中 小】
 种稀酸溶液,并放出a KJ的热量。写出该反应的热化学方程式__________________________________。 种稀酸溶液,并放出a KJ的热量。写出该反应的热化学方程式__________________________________。
参考答案:(10分)
(1)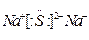
(2)HCl>H2S
(3)S2->Cl >Na+>Al3+
(4)B D
(5)Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4Q kJ/mol
本题解析:略
本题难度:一般
3、选择题 欲寻求新的催化剂和制造耐高温、耐腐蚀的合金材料,应对元素周期表中进行研究的区域是(?)
A.碱金属
B.第ⅡA族元素
C.过渡元素
D.金属与非金属分界线附近的元素
参考答案:C
本题解析:元素周期表中位置相近的元素性质相似,因此人们可以在元素周期表中一定的区域内研究合成有特定性质的新物质。如在金属和非金属的分界线附近寻找半导体材料(如锗、硅、硒等),在过渡元素中寻找优良的催化剂和耐高温、耐腐蚀的合金材料(如制造火箭、飞机的钛、钼等元素)。
本题难度:简单
4、填空题 A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。
(1) A??;D?(填元素名称)
(2)写出C、D两元素形成的常见化合物的电子式?;写出由A、B两元素形成的18电子微粒中所含化学键类型?。
(3)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止气体透过的隔膜。在一极通人A的单质,另一极通人B的单质,写出该电池发生的电极反应式:
通入A单质的一极:?;
通入B单质的一极:?。?
(4)由A、B、C 三元素构成的化合物X,常在试验制备过程中起尾气吸收作用。请写出化合物X吸收NO2 时所发生反应的离子方程式:??。
参考答案:(1) 氢?;硫(各1分)?
(2)??;(2分);极性共价键、非极性共价键(各一分,只答共价键得一分)
(3)2H2 -4e- + 4OH- = 4H2O? O2 +4e- + 2H2O =4OH-(各2分)
(4)2NO2 +2OH- = NO3- +NO2- + H2O(2分)
本题解析:根据元素的结构及有关性质可知,A,B,C,D分别是H、O、Na、S。(1)名称分别是氢、氧、钠、硫。(2))写出C、D两元素形成的常见化合物是硫化钠,其电子式要体现出阴阳离子形式;钠和S都是活泼的金属和非金属,形成的化学键是离子键,电子式为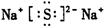 。A、B两元素形成的18电子微粒是过氧化氢,其中所含化学键类型极性共价键、非极性共价键。符合条件的两种物质分别是硫酸氢钠和亚硫酸氢钠,方程式为HSO3-+H+=SO2↑+H2O。(3)原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应,所以氢气在负极通入,氧气在正极通入。又因为溶液显碱性,所以电极反应式为负极: 。A、B两元素形成的18电子微粒是过氧化氢,其中所含化学键类型极性共价键、非极性共价键。符合条件的两种物质分别是硫酸氢钠和亚硫酸氢钠,方程式为HSO3-+H+=SO2↑+H2O。(3)原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应,所以氢气在负极通入,氧气在正极通入。又因为溶液显碱性,所以电极反应式为负极: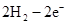  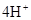 ,正极: ,正极: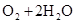 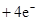  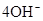 。(4)由A、B、C 三元素构成的化合物X是氢氧化钠,离子方程式为:2NO2 +2OH- = NO3- +NO2- + H2O。 。(4)由A、B、C 三元素构成的化合物X是氢氧化钠,离子方程式为:2NO2 +2OH- = NO3- +NO2- + H2O。
本题难度:一般
5、填空题 A、B、C、D、E为五种原子序数依次增大的短周期主族元素。已知B的最外层电子数
与核外电子总数之比为3∶4;D的最外层电子数与次外层电子数之比为3∶4;E-、C+、A+的半径逐渐减小;常温下化合物AE为气体。
请回答下列问题:
(1)D、E的最高价氧化物对应水化物酸性较强的是________(写化学式)。
(2)用惰性电极电解化合物CE的饱和溶液,当电路中有0.2 mol电子通过时两极产生的气体在标准状况下的体积共________L。
(3)A与B、A与D均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:________。
(4)化合物乙、丙均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,乙溶液中水的电离程度比纯水的小。则化合物乙中的化学键类型为________;若丙为常见家用消毒剂的主要成分,则丙的化学式是________。
(5)均由A、B、C、D四种元素组成的两种盐发生反应的离子方程式是________;其中一种是强酸对应的酸式盐,写出向Ba(OH)2溶液中逐滴加入该盐溶液至中性发生反应的离子方程式:________。
参考答案:(1)HClO4
(2)4.48
(3)H2O2+H2S=S↓+2H2O
(4)离子键、(极性)共价键 NaClO
(5)HSO3-+H+=H2O+SO2↑ Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
本题解析:短周期元素的内层电子数可能是2或10,设B的最外层电子数为x,则x∶(2+x)=3∶4,x=6,或x∶(10+x)=3∶4,x=30,不存在,因此元素B为O;次外层电子数可能是2或8,D的次外层电子数只能为8,最外层电子数为6,因此元素D为S;相应的元素E只能是Cl,由于AE常温下为气体,A显+1价,因此元素A为H,根据C+,且原子序数介于8和16之间,得出元素C为Na。
(1)D、E的最高价氧化物对应的水化物分别是H2SO4、HClO4,由于Cl的非金属性较强,所以HClO4的酸性强于H2SO4的。(2)电解氯化钠溶液时,阳、阴两极,分别发生反应2Cl--2e-=Cl2↑、2H++2e-=H2↑,共得到0.2 mol气体,在标准状况下的体积为4.48 L。(3)A与B、A与D形成的18电子的分子分别是H2O2、H2S,两者发生氧化还原反应得到单质S。(4)乙和丙都是强电解质,可能是钠的化合物,乙抑制水的电离,可能是碱或酸,因此乙是氢氧化钠,丙是常见家用消毒剂的主要成分,应为次氯酸钠。(5)由A、B、C、D四种元素组成的两种盐可能是硫酸氢钠和亚硫酸氢钠,两者能发生反应。
本题难度:一般
|  种稀酸溶液,并放出a KJ的热量。写出该反应的热化学方程式__________________________________。
种稀酸溶液,并放出a KJ的热量。写出该反应的热化学方程式__________________________________。