1、简答题 (16分)NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义。
(1)氮氧化物产生的环境问题有?(填一种)。
(2)氧化—还原法消除氮氧化物的转化如下:
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是?mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是?。
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g)?△H=-41.8 kJ·mol-1
SO3(g)+NO(g)?△H=-41.8 kJ·mol-1
①已知:2SO2(g)+O2(g) 2SO3(g)?△H=-196.6 kJ·mol-1
2SO3(g)?△H=-196.6 kJ·mol-1
写出NO和O2反应生成NO2的热化学方程式?。
②一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO 和NO2的浓度之比为3∶1,则NO2的平衡转化率是?。
③上述反应达平衡后,其它条件不变时,再往容器中同时充入
NO2、SO2、SO3、NO各1mol,平衡?(填序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图,电极为多孔惰性材料。则负极的电极反应式是?。

参考答案:(1)产生光化学烟雾或形成酸雨(1分) (2)①1(2分)
②6NO2+4CO(NH2)2=7N2+8H2O+4CO2(3分)
(3)①2NO(g)+O2(g) = 2NO2(g)?△H=-113.0 kJ·mol-1(3分) ②75%(2分)③A(2分)
(4)NO-3e-+2H2O=NO3-+4H+(3分)
本题解析:(1)氮氧化物产生的环境问题有产生光化学烟雾或形成酸雨等。
(2)①根据反应NO+O3=NO2+O2可知,每生成生成1mol氧气,反应中氮元素的化合价就从+2价升高到+4价,失去2个电子,则11.2 L O2(标准状况)即0.5mol氧气时,转移电子的物质的量是1mol。
②反应ⅡNO2中氮元素的化合价是+4价,而尿素中氮元素的化合价是-3价,当n(NO2)∶n[CO(NH2)2]=3∶2时,根据电子得失守恒可知,氮原子均转化为氮气,则根据原子守恒可知,其余产物是水和CO2,所以反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2。
(3)①已知:反应2SO2(g)+O2(g) 2SO3(g)?△H=-196.6 kJ·mol-1、NO2(g)+SO2(g)
2SO3(g)?△H=-196.6 kJ·mol-1、NO2(g)+SO2(g) SO3(g)+NO(g)?△H=-41.8 kJ·mol-1,则根据盖斯定律可知前者减去后者乘以2即得到2NO(g)+O2(g) = 2NO2(g),则△H=-196.6 kJ·mol-1+41.8 kJ·mol-1×2=-113.0 kJ·mol-1。
SO3(g)+NO(g)?△H=-41.8 kJ·mol-1,则根据盖斯定律可知前者减去后者乘以2即得到2NO(g)+O2(g) = 2NO2(g),则△H=-196.6 kJ·mol-1+41.8 kJ·mol-1×2=-113.0 kJ·mol-1。
②? NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
起始量(mol) 1? 1?0? 0
转化量(mol) x? x? x? x
平衡量(mol)1-x? 1-x? x? x
则根据容器中NO 和NO2的浓度之比为3∶1可知x:(1-x)=3∶1
解得x=0.75
所以NO2的平衡转化率是75%
③反应前后体积不变,则可以用物质的量代替浓度计算平衡常数,则根据②可知,该温度下反应的平衡常数K=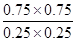 ?=9。若其它条件不变时,再往容器中同时充入NO2、SO2、SO3、NO各1mol,则此时
?=9。若其它条件不变时,再往容器中同时充入NO2、SO2、SO3、NO各1mol,则此时 ?=1.96<9,所以反应向正反应方向进行,答案选A。
?=1.96<9,所以反应向正反应方向进行,答案选A。
(4)原电池中负极失去电子,发生氧化反应,因此NO在负极通入,氧气在正极通入。电解质溶液显酸性,因此负极电极反应式为NO-3e-+2H2O=NO3-+4H+。
本题难度:一般
2、选择题 在某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应: aA(气)+ B(气) C(气)+ D(气) 5 min后达到平衡。已知各物质的平衡浓度的关系为:[A]a [B] = [C][D],若在温度不变情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为
C(气)+ D(气) 5 min后达到平衡。已知各物质的平衡浓度的关系为:[A]a [B] = [C][D],若在温度不变情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为
[? ]
A.60%
B.40%
C.24%
D.4%
参考答案:B
本题解析:
本题难度:一般
3、计算题 在一定条件下,将物质的量之比为1∶3的N2和H2?102g通入密闭容器中,达到平衡后,测知混合气体的平均相对分子质量为12.5。求混合气体中NH3的质量?
参考答案:32.64g
本题解析:设N2的物质的量为x,则H2的物质的量是3x,由题意知,28g/mol×x+2g/mol×3x=102g,解之,得:x=3mol。又由:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
n(开始)/mol: 3? 9? 0
n(转化)/mol:? a? 3a? 2a?
n(平衡)/mol: 3-a? 9-3a?2a
(3-a)+(9-3a)+2a= =8.16mol
=8.16mol
解之,得:a=1.92mol。
则混合气体中NH3的质量为:2×1.92mol×17g/mol=32.64
本题难度:简单
4、选择题 恒温恒容条件下,下列叙述正确的是
A.相同的甲、乙两容器中分别加入1 g SO2、1 g O2与2 g SO2、2 g O2,发生反应2SO2(g)+O2(g)  SO3(g)达到平衡,SO2的转化率前者大
SO3(g)达到平衡,SO2的转化率前者大
B.反应2HI(g)  H2(g)+I2(g)达到平衡,增大HI的物质的量,平衡不移动
H2(g)+I2(g)达到平衡,增大HI的物质的量,平衡不移动
C.反应2NO2(g )  N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡时,与第一次平衡时相比,NO2的体积分数增大
N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡时,与第一次平衡时相比,NO2的体积分数增大
D.反应2HI(g)  H2(g)+I2(g)达到平衡,增大HI的物质的量,HI的分解率和体积分数均不变
H2(g)+I2(g)达到平衡,增大HI的物质的量,HI的分解率和体积分数均不变
来源:www.91exam.org
参考答案:D
本题解析:A中后者c(SO2)、c(O2)大,则压强大,所以后者SO2的转化率大;
B中增大HI的物质的量,即增大了c(HI),平衡右移;但压强的增大不影响平衡移动,所以达到的新平衡态与原平衡态相同,故D正确;
C中再向容器内通入一定量的NO2(g),即增大了c(NO2),平衡右移,所以:重新达到平衡时,与第一次平衡时相比,NO2的体积分数减小;
本题难度:一般
5、选择题 对可逆反应2A(s)+3B(g)  ?C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
?C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v (正)、v(逆)不变?
④增大B的浓度,v(正)>v(逆)?⑤加入催化剂,B的转化率提高
A.①②
B.④
C.③
D.④⑤
参考答案:B
本题解析:物质A是固体,增加A的质量平衡不移动,①不正确。升高温度反应速率都是增大的,②不正确。反应前后体积不变,增大压强平衡不移动,但反应速率都是增大的,③不正确。增大B的浓度,平衡向正反应方向移动,正反应速率大于逆反应速率,④正确。催化剂只能改变反应速率,不影响平衡状态,⑤不正确,所以答案选B。
本题难度:一般