1、选择题 有NaCl、FeCl2、FeCl3、MgCl2、CuCl2、AlCl3、NH4Cl六种溶液,只用一种试剂就可以把它们鉴别开来,该试剂是( )
A.H2SO4
B.NaOH溶液
C.氨水
D.KSCN溶液
参考答案:A、加入硫酸溶液,六种溶液都无现象,所以不能鉴别,故A错误;
B、加入氢氧化钠溶液,氯化钠无现象,FeCl2生成白色沉淀,迅速变成灰绿色,最后总变成红褐色,氯化铁生成红褐色沉淀,氯化铜生成蓝色沉淀,氯化铝生成白色沉淀,NaOH过量时,沉淀逐渐溶解消失,氯化铵生成刺激性气体,六种物质现象各不相同,可鉴别,故B正确;
C、加入氨水,氯化镁生成白色沉淀,氯化铝生成白色沉淀,氯化钠和氯化铵无现象,所以不能鉴别,故C错误;
D、加入硫氰化钾溶液,只有氯化铁溶液变成血红色,其它无现象,所以不能鉴别,故D错误.
故选B.
本题解析:
本题难度:一般
2、简答题 在如右图所示的实验装置中,盛有足量水的水槽里放两个烧杯,小烧杯里放有铜片和浓硝酸,小烧杯外面倒扣一大烧杯,请回答下列问题:
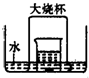 (1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)
(1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)
①______;②______;
③______;④______;
(2)欲使反应更快进行,应向小烧杯中加入______(填“粗铜片”或“纯铜片”),其原因是______.
(3)用该装置做铜与浓硝酸反应的实验,最突出的优点是______.
(4)若要验证最终得到的气体中是否有NO,最简便的方法是______.若实验证明最终得到的气体中无NO,则实验结束后大烧杯中液面的变化情况是______.
(5)工业上吸收NO和NO2的混合气体,常使用NaOH溶液.欲使NO和NO2被充分吸收,则NO和NO2的体积应满足______.
(NO+NO2+2NaOH=2NaNO2+H2O)
a.V(NO)>V(NO2)b.V(NO)<V(NO2)c.V(NO)≤V(NO2)
参考答案:(1)铜与浓硝酸反应生成硝酸铜和红棕色的二氧化氮气体,同业颜色为蓝色,二氧化氮气体可与水反应生成无色的一氧化氮和硝酸,
故答案为:①铜片表面产生气泡,铜片慢慢溶解;②小烧杯中溶液的颜色逐渐变成蓝色;③大烧杯中有红棕色气体生成,后来慢慢变成无色;
(2)粗铜含有其它金属或非金属,在溶液中可形成原电池反应,反应速率增大,故答案为:粗铜片;粗铜片在反应中可形成原电池,加速反应的进行;
(3)因Cu与浓HNO3反应生成的NO2和间接得到的NO,都是污染性气体,必须有尾气吸收装置,对比传统实验,所以该装置最突出的优点是:没有尾气处理装置,却无氮氧化合物逸出,不污染环境,
故答案为:反应体系封闭,无氮氧化物逸出,不污染环境;
(4)一氧化氮与氧气反应生成二氧化氮,颜色变为红棕色,可轻轻掀起倒扣的大烧杯,放入适量的空气,若有红棕色气体生成,则证明最终气体生成物为NO气体,若实验证明最终得到的气体中无NO,二氧化氮与水反应生成硝酸和一氧化氮,压强减小,则实验结束后大烧杯中液面上升,
故答案为:轻轻掀起倒扣的大烧杯,放入适量的空气,若有红棕色气体生成,则证明最终气体生成物为NO气体;液面上升;
(5)因2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO2+2NaOH=2NaNO2+H2O,观察两个方程式,则只要NO2气体比NO多,则混合气体就能够被NaOH溶液完全吸收,所以V(NO2):V(NO)≥1,故答案为:C.
本题解析:
本题难度:一般
3、实验题 (共22分)某实验小组用下列装置进行如下的实验。?
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
?、?。
实验小组在不断鼓入空气的情况下,熄灭酒精灯,发现反应仍能继续进行,说明该反应是? ? ?反应。
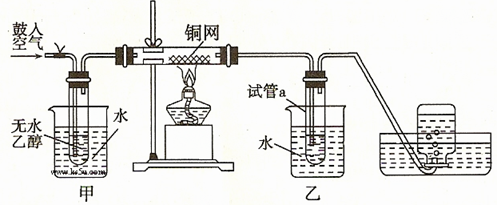
(2)甲和乙两个水浴作用不相同。甲的作用是?;
乙的作用是?。
(3)反应进行一段时间后,干燥的試管a中能收集到不同的物质,那么收集到的有机物是(请填写其结构简式)?;集气瓶中收集到的气体的最主要成分是?。(填写气体的分子式)
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,实验小组的同学认为这可能是存在副产物乙酸。除去该物质,可以使用厨房中常见的一种化合物,该物质为? 。(填写化学式或分子式)
。(填写化学式或分子式)
(5)请写出以上实验涉及的有机物乙醇在生活生产中的一种具体应用:?。
(6)该实验的目的是:?
参考答案:(1)(6分)2Cu+O2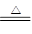 2CuO? CH3CH2OH+CuO
2CuO? CH3CH2OH+CuO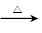 CH3CHO+Cu+H2O?放热反应
CH3CHO+Cu+H2O?放热反应
(2)(4分)加热?冷却?(3)(6分)乙醛?乙醇?氮气?
(4)(2分)Na2CO3或NaHCO3?
(5)(2分)如:乙醇用来消毒等;(6)(2分)探究乙醇催化氧化实验
本题解析:考查乙醇催化氧化原理
(1)红色是铜的颜色,黑色是氧化铜的颜色。说明在加热的条件下铜被空气氧化生成氧化铜,氧化铜在加热的条件下又被乙醇还原生成了铜。熄灭酒精灯后,反应仍然能进行,说明反应是放热反应,放出的热量足以维持反应的进行。
(2)根据装置可判断,进入玻璃管的是乙醇气体,所以通过加热使乙醇挥发,产生乙醇气体。而要得到生成物乙醛,就必须降低温度,使乙醛液化变成液体,便于收集。
(3)反应连续进行的,即部分乙醇来不及被氧化,和生成的乙醛一同进入小试管中。而空气中的氮气难溶于水,且不参与反应,被收集到集气瓶中。
(4)试纸显红色,说明溶液显酸性,这说明在反应过程中有乙酸生成,所以要除去乙酸,可以用碳酸氢钠或碳酸钠溶液即可。
(5)75%的酒精溶液,常原来作消毒剂。
(6)根据实验原理及装置可知实验目的是来探究乙醇催化氧化实验的。
本题难度:一般
4、选择题 配制一定体积、一定物质的量浓度的溶液,正确情况对实验结果产生偏低影响的是
A.容量瓶中原有少量蒸馏水
B.溶解所用的烧杯未洗涤
C.定容时仰视观察液面
D.定容时俯视观察液面
参考答案:B C
本题解析:A 容量瓶中原有少量蒸馏水,对配置结果无影响
B?溶解所用的烧杯未洗涤,说明溶质未全部转移到容量瓶中,所配溶液浓度偏低
C 定容时仰视观察液面,比平视时加得水多,所配溶液浓度偏低
D 定容时俯视观察液面,比平视时加得水少,所配溶液浓度偏高。
本题难度:一般
5、简答题 实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应式如下:
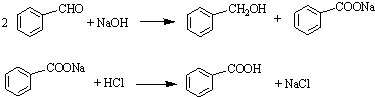
已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)
②乙醚沸点34.6℃,相对密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸.
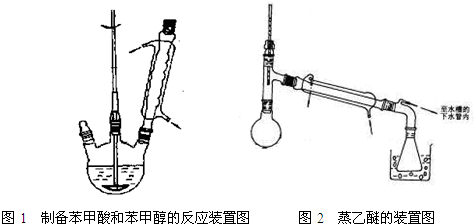
实验步骤如下:
①向图1所示装置中加入8g氢氧化钠和30mL水,搅拌溶解.稍冷,加入10mL新蒸过的苯甲醛.开启搅拌器,调整转速,使搅拌平稳进行.加热回流约40min.
②停止加热,从球形冷凝管上口缓缓加入冷水20mL,摇动均匀,冷却至室温.反应物冷却至室温后,倒入分液漏斗,用乙醚萃取三次,每次10mL.水层保留待用.合并三次萃取液,依次用5mL饱和亚硫酸氢钠溶液洗涤,10mL10%碳酸钠溶液洗涤,10mL水洗涤.
③分出醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞.将锥形瓶中溶液转入图2所示蒸馏装置,缓缓加热蒸馏除去乙醚.当温度升到140℃时改用空气冷凝管,收集198℃~204℃的馏分得产品A.将萃取后的水溶液慢慢地加入到盛有30mL浓盐酸和30mL水的混合物中,同时用玻璃棒搅拌,析出白色固体.冷却,过滤,得到粗产品,然后提纯得产品B.
根据以上步骤回答下列问题:
(1)步骤①中所加的苯甲醛为什么要是新蒸过的?______.
(2)步骤②萃取时用到的玻璃仪器有烧杯、______,饱和亚硫酸氢钠溶液洗涤是为了除去未反应完的苯甲醛,而碳酸钠溶液洗涤是为了除去______.
(3)步骤③中无水硫酸镁的作用是______,将锥形瓶中溶液转入图2所示蒸馏装置时涉及的实验操作为______.
(4)产品A为______,蒸馏除去乙醚的过程中采用的加热方式为______.提纯产品B所用到的实验操作为______.
参考答案:(1)苯甲醛不稳定易被氧化生成苯甲酸,从而会使苯甲醇的产量减少,所以为防止苯甲醇的产量减少,所以所加的苯甲醛是新蒸过的,
故答案为:保存时间较长的苯甲醛已部分氧化成苯甲酸会使苯甲醇的产量相对减少;
(2)用于萃取的仪器是分液漏斗,碳酸钠溶液呈碱性,能和酸反应生成二氧化碳,所以加入碳酸钠的目的是除去醚层中极少量的苯甲酸,
故答案为:分液漏斗;醚层中极少量的苯甲酸;
(3)加无水硫酸镁的作用是吸收水蒸气,起到干燥的作用,将锥形瓶中溶液转入图2所示蒸馏装置时涉及的实验操作为过滤,
故答案为:干燥剂;过滤;
(4)203℃~205℃的馏分,依据沸点判断馏出成分为苯甲醇;乙醚沸点34.6℃,蒸馏除乙醚的过程中采用的加热方式应用水浴加热,易于控制温度,实验步骤②中保留待用水层慢慢地加入到盛有30mL浓盐酸和30mL水的混合物中,同时用玻璃棒搅拌,析出白色固体,冷却,抽滤,得到粗产品,然后提纯得产品B,需要几次溶解后再结晶的操作,进行析出提纯,操作方法为:重结晶,
故答案为:苯甲醇;水浴加热;重结晶.
本题解析:
本题难度:一般