|
高中化学知识点总结《气体的净化、干燥、吸收与收集》高频考点特训(2020年练习版)(六)
2021-02-18 06:13:37
【 大 中 小】
|
1、选择题 下列气体只能用排水法收集的是
A.NO
B.SO2
C.NH3
D.Cl2
参考答案:A
本题解析:NO极易被氧化生成NO2,只能用排水法收集,其余选项都可以用排空气法收集,答案选A。
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固与训练,难度不大。该题的关键是记住常见气体的性质,然后灵活运用即可。
本题难度:简单
2、实验题 (8分)
氯化铵是一种重要的化工原料,应用广泛。
(1)实验室通常用NH4Cl固体与Ca(OH)2固体混合共热制取氨气。
写出实验室制取氨气的反应方程式? 。
(2)用浓氯化铵溶液处理的舞台幕布难着火,其原因是?(填字母)。
①幕布的着火点升高?②幕布的质量增加?③氯化铵分解吸收热量,降低了温度
④氯化铵分解产生的气体隔离了部分空气
A.①②
B.③④
C.①③
D.②④
| (3)实验室可用NH4Cl溶液与饱和的NaNO2溶液反应制取纯净的氮气,反应方程式为:
NaNO2+NH4Cl NaCl+N2↑+2H2O实验装置如图所示,试回答: NaCl+N2↑+2H2O实验装置如图所示,试回答:
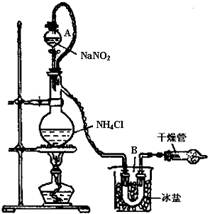
①装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是?(填写编号)。
a.防止饱和溶液蒸发
b.保证实验装置不漏气
c.使饱和NaNO2溶液容易滴下
②加热前必须进行的一个操作步骤是? ?。
参考答案:(1)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O; CaCl2+2NH3↑+2H2O;
(2)B
(3)c;检查气密性
本题解析:考查气体的制取
(1)实验室通常用铵盐及碱来制取氨气:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O; CaCl2+2NH3↑+2H2O;
(2)考查燃烧的必备条件;
通过反应NH4Cl NH3↑+H2O分解吸收热量,降低温度,使幕布达不到着火点;再者分解产生的氨气可隔绝氧气,使其不能燃烧,故选B NH3↑+H2O分解吸收热量,降低温度,使幕布达不到着火点;再者分解产生的氨气可隔绝氧气,使其不能燃烧,故选B
(3)①分液漏斗与蒸馏烧瓶之间连接的导管可平衡两者之间的压强,让反应液易于滴下
②对于制取气体的实验装置,气密性检查必不可少
本题难度:一般
3、实验题 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
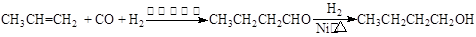 ? ?
CO的制备原理:HCOOH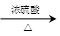 CO↑+H2O,并设计出原料气的制备装置(如下图) CO↑+H2O,并设计出原料气的制备装置(如下图)
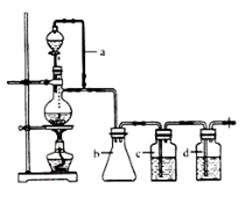
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯。写出制备丙烯的化学方程式:?。
(2)若用以上装置制备干燥纯净的CO,装置中a的作用是?,装置中b的作用是?,c中盛装的试剂是?。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是?(填序号)
①饱和Na2SO3溶液;②酸性KMnO4溶液;③石灰水;④无水CuSO4;⑤品红溶液
(4)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和) RCH(OH)SO3Na↓;②沸点:乙醚34℃, RCH(OH)SO3Na↓;②沸点:乙醚34℃,
1-丁醇118℃,并设计出如下提纯路线:
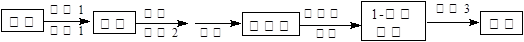
试剂1为 ?,操作2为?,操作3为?。
参考答案:(1)(CH3)2CHOH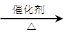 CH2=CHCH3↑+H2O;(2分) CH2=CHCH3↑+H2O;(2分)
(2)保证分液漏斗内外压强平衡,便于液体顺利流下。(2分)
作为安全瓶,防倒吸 (2分)? NaOH溶液 (2分)
(3)④⑤①⑤③②(答④⑤①③②也给分)(2分)
(4)饱和NaHSO3溶液(2分)?萃取(2分)?蒸馏(2分)
本题解析:(1)氢气可用活泼金属锌与非氧化性酸盐酸通过置换反应制备,氧化性酸如硝酸和浓硫酸与锌反应不能产生氢气,方程式为Zn+2HCl=ZnCl2+H2↑;2-丙醇通过消去反应即到达丙烯,方程式为:(CH3)2CHOH CH2=CHCH3↑+H2O,故答案为:Zn+2HCl=ZnCl2+H2↑;(CH3)2CHOH CH2=CHCH3↑+H2O,故答案为:Zn+2HCl=ZnCl2+H2↑;(CH3)2CHOH CH2=CHCH3↑+H2O; CH2=CHCH3↑+H2O;
(2)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.又因为甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO.为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;若用以上装置制备氢气,就不再需要加热,所以此时发生装置中的玻璃仪器名称是分液漏斗和蒸馏烧瓶;氢气密度小于空气的,因此要收集干燥的氢气,就只能用向下排空气法,而不能用排水法收集;故答案为:恒压,防倒吸;?NaOH溶液,浓H2SO4;分液漏斗、蒸馏烧瓶; ; ;
(3)检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液褪色、品红溶液或石灰水,检验CO2可以石灰水,检验水蒸气可以无水CuSO4,所以在检验这四种气体必需考虑试剂的选择和顺序.只要通过溶液,就会产生水蒸气,因此先检验水蒸气;然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,最后检验CO2和丙烯,因此顺序为④⑤①②③(或④⑤①③②),故答案为:④⑤①②③(或④⑤①③②);
(4)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇.因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开.
故答案为:饱和NaHSO3溶液;过滤;萃取;蒸馏.
本题难度:一般
4、实验题 (2014届山东省济南市高三3月模拟考试理综化学试卷)
氯碱工业是最基本的化学工业之一,它的产品应用广泛。请回答下列问题:
(1)氯碱工业是利用电解食盐水生产?为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入下列试剂的顺序合理的是?(填下列各项中序号)。
a、碳酸钠、氢氧化钠、氯化钡? b、碳酸钠、氯化钡、氢氧化钠
c、氢氧化钠、碳酸钠、氯化钡? d、氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
成分
| NaCl
| Mg(OH)2
| CaCO3
| BaSO4
| 其他不溶物
| 质量分数(%)
| 15~20
| 15~20
| 5~10
| 30~40
| 10~15
|
?
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。
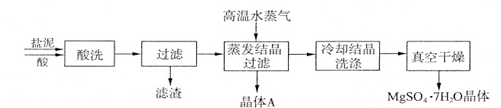
回答下列问题:
①酸洗过程中加入的酸为?,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 ?。
②过滤所得滤渣的主要成分为??。
③根据图分析,蒸发结晶过滤所得晶体A主要成分为?。
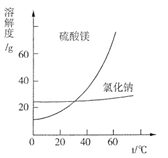
④真空干燥MgSO4·7H2O晶体的原因是?。
参考答案:(12分)
(1)(2分)烧碱、氯气(氢气)
(2)(2分)d
(3)(8分)①(稀)硫酸(1分);硫酸能与碳酸钙反应,搅拌过程中产生的CO2不断逸出,碳酸钙转化为硫酸钙(1分)
②BaSO4、CaSO4等不溶于酸的物质(2分,答出BaSO4即可) ③NaCl(2分)
④防止失去结晶水(2分)
本题解析:
(1)电解食盐水生成NaOH、H2、Cl2,所以氯碱工业是利用电解食盐水生产烧碱、氯气(氢气)为基础的工业体系。
(2)Na2CO3的作用除了除去Ca2+外,还有除去过量的BaCl2的作用,所以Na2CO3的顺序在BaCl2的后面,只有d项符合。
(3)①因为最终产品为MgSO4·7H2O,为避免生成杂质,应加入稀硫酸;加入硫酸后,H2SO4和CaCO3发生反应:H2SO4+CaCO3=CaSO4+CO2↑+H2O,搅拌过程中产生的CO2不断逸出,碳酸钙转化为硫酸钙。
②盐泥含有BaSO4,加入H2SO4后CaCO3转化为CaSO4,所以过滤所得滤渣的主要成分为BaSO4、CaSO4等不溶于酸的物质。
③蒸发结晶时温度较高,MgSO4溶解度大,所以析出NaCl,过滤所得滤渣的主要成分为NaCl。
④在空气中干燥即烘干MgSO4·7H2O,MgSO4·7H2O容易失去结晶水,所以真空干燥MgSO4·7H2O晶体的原因是防止失去结晶水。
本题难度:一般
5、选择题 检验Cl2是否充满了集气瓶的正确操作为
[? ]
A.用玻璃棒粘上湿润的碘化钾淀粉试纸伸到集气瓶口附近,观察试纸是否变蓝
B.将AgNO3溶液滴入集气瓶中.观察有无白色沉淀生成
C.用玻璃棒蘸取少许NaOH溶液放人集气瓶口附近,看是否反应
D.用手将湿润的碘化钾淀粉试纸放在集气瓶口上方,观察颜色是否变蓝
参考答案:A
本题解析:
本题难度:简单
|  NaCl+N2↑+2H2O实验装置如图所示,试回答:
NaCl+N2↑+2H2O实验装置如图所示,试回答:

