1、填空题 (12分) 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入肼的一极为?极,该极的电极反应式是?,电池工作一段时间后,电解质溶液的pH将?(填“增大”、“减小”、“不变”)。
(2)肼用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式?。
(3)肼和四氧化二氮作火箭推进剂,两者反应产物是氮气和水。当反应生成28.0kg还原产物时,计算参加反应的肼的质量 (写出计算过程) 。
参考答案:(12分)
(1)负极? N2H4 + 4OH--4e-= N2↑ + 4H2O?减小?(每空2分)
(2)N2H4 + HNO2 = HN3 + 2H2O?(2分)
(3)根据2N2H4+N2O4=3N2+4H2O找出参加反应的N2H4与还原产物N2之间的关系式为
2N2H4?~ N2
64? 28
m(N2H4)?28kg
m(N2H4)="64×28kg/28=64kg?" (找出关系式2分,结果正确2分)
本题解析:略
本题难度:一般
2、简答题 金属具有良好的导电、导热及延展性等,因此广泛应用于制造各种材料.请回答下列问题:
(1)家庭中“钢精锅”是由铝合金做成的,它能长期使用的原因是:______.
(2)下列关于铁制品保护措施的说法中不正确的有______(填序号).
①在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油
②相同条件下,马口铁(表层镀锡)与白铁(表层镀锌)相比,马口铁更为耐用
③在海轮的外壳上常焊有锌块,且定期更新
④将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理.
参考答案:(1)铝是亲氧元素,在空气中极易和氧气反应生成的氧化铝保护膜,阻止了铝的进一步反应,从而达到保护的目的.
故答案为:致密的氧化物保护膜.?
(2)①在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油,铬性质不活泼,机油或黄油不溶于水,所以能阻止金属被腐蚀,故正确.
②相同条件下,马口铁(表层镀锡)中铁比锡活泼,铁和锡形成的原电池中,铁较易腐蚀;白铁(表层镀锌)中锌较活泼,锌和铁形成的原电池中锌作负极,从而保护了铁,所以白铁皮更为耐用,故错误.
③在海轮的外壳上常焊有锌块,且定期更新,锌和铁形成的原电池中锌作负极,从而保护了铁,故正确.
④将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理,阻止了铁和其它物质反应从而保护了铁,故正确.
故选②.
本题解析:
本题难度:一般
3、选择题 下列关于金属腐蚀叙述正确的是?
[? ]
A.金属在潮湿空气中腐蚀的实质是:M+nH2O===M(OH)n+n/2H2↑
B.金属的化学腐蚀的实质是M-ne-===Mn+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀
参考答案:B
本题解析:
本题难度:简单
4、选择题 在面盆、痰盂等铁制品表面烧制搪瓷的目的是( )
A.防止铁生锈且美观
B.增大厚度防止磨损
C.增大硬度防止撞坏
D.美观和杀菌消毒作用
参考答案:A
本题解析:
本题难度:简单
5、填空题 按图4-7装置进行实验,并回答下列有关问题。
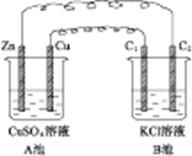
图4-7
(1)判断装置的名称:A池为?,B池为?。
(2)锌为?极,电极反应式为?。铜为?极,电极反应式为?。石墨棒C1为?极,电极反应式为?。石墨棒C2为?极,电极反应式为?。
(3)当C2极上析出224 mL气体(标准状况)时,锌的质量变化了(“增加”或“减少”)?g,CuSO4溶液的质量变化了(“增加”或“减少”)?g。
参考答案:(1)原电池电解池
(2)负Zn-2e-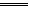 Zn2+
Zn2+
正Cu2++2e-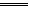 Cu
Cu
阳4OH--4e-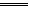 2H2O+O2↑
2H2O+O2↑
阴4H++4e-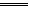 2H2↑
2H2↑
(3)减少0.65?增加0.01
本题解析:A池中Zn、Cu放入CuSO4溶液中,它们构成原电池。B池中,两个电极均为石墨电极,在以A池为电源的情况下构成电解池。即以A为原电池来带动B电解池。A池中Zn为负极,Cu为正极;B池中C1为阳极,C2为阴极,C2极上析出的气体为H2,C2极上析出H2为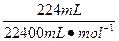 =0.01 mol。
=0.01 mol。
电路上转移电子物质的量为0.01 mol×2=0.02 mol。
因得失电子守恒,故Zn极上有0.01 mol的Zn溶解,即Zn极质量减少0.01 mol×65 g·mol-1=0.65 g。
Cu极上有0.01 mol的Cu析出,即CuSO4溶液的质量增加了0.01 mol×(65-64) g·mol-1=0.01 g。
本题难度:简单