1、实验题 某课外活动小组同学用如图Ⅰ装置进行实验,试回答下列问题。
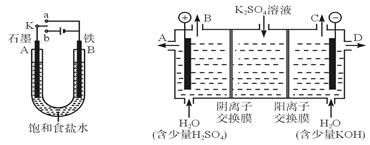
图I?图II
(1)若开始时开关K与a连接,则B极的电极反应式为_____________。
(2)若开始时开关K与b连接,则总反应的离子方程式为_______?______;
有关上述实验,下列说法正确的是(填序号)_____________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模仿工业上用离子交换膜法制烧碱的方法,设想用如图Ⅱ装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽工作时,通过阴离子交换膜的离子数_______(填“大于” “小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因_____? ________。
(4)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为?。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于图Ⅱ离子交换膜法的电解产物,理论上需消耗硫酸钾质量为?kg。
参考答案:(1)Fe-2e—=Fe2+? (2)2Cl— + 2H2O="==" H2↑ + Cl2↑ + 2OH—? BD
(3) 小于?由于氢离子在阴极放电,促进了水的电离,导致溶液中OH-浓度增大(3分)
(4)SiCl4+2H2+O2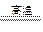 SiO2+4HCl? 0.522
SiO2+4HCl? 0.522
本题解析:略
本题难度:一般
2、选择题 观察下列几个装置示意图,有关叙述正确的是

A.装置①中阳极上析出红色固体
B.装置②中铜片应与电源负极相连
C.装置③中外电路电流方向:b极 →a极
D.装置④中阴极反应:2 Cl--2e-= Cl2
参考答案:C
本题解析:A、阳极失电子,所以应该生成氯气,而红色的铜应该在阴极析出;B、镀层金属应该要失去电子进入溶液中,所以应该为阳极与电源正极相连;C、H2失电子为负极、O2得电子为正极,电子由a流向b,所以电流由b流向a;D、阴极得电子,应该H+得电子生成H2
本题难度:一般
3、填空题 (16分)如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题:
(1)打开K2,闭合K1,B为__________极,A的电极反应为______________,最终可观察到的现象是?。
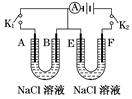
(2)打开K1,闭合K2,E为________极,检验F极产生气体的方法是?。
(3)若往U型管中滴加酚酞,进行(1)、(2)操作时,?极周围能变红(填A、B、E、或F,下同)。若滴加K3[Fe(CN)6]溶液,在?极周围溶液变为?色。
(4)若电源选用燃料电池,结构如图,以熔融碳酸盐为电解质(能够传导CO32-),电池工作时电解质组成保持稳定,请写出正极反应的方程式?,若在标况下消耗11.2L的甲烷,电解NaCl溶液产生的H2的物质的量为?mol(假设燃料电池能量转化率为75%)。
xk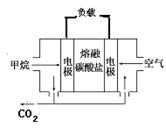
参考答案:(1)负;(1分)O2+2H2O+4e-===4OH-;(2分)溶液中有红褐色沉淀生成(2分)(2)阴;(1分)用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气(2分)(3)A、E;(2分)B;(1分)蓝(1分)(4)2CO2+O2+4e-=2CO32-(2分);1.5(2分)
本题解析:(1)打开K2,闭合K1后,构成原电池,B是铁片,作负极,A是正极,由于溶液是氯化钠溶液,因此相当于铁的吸氧腐蚀,正极反应式为O2+2H2O+4e-===4OH-。铁失去电子生成亚铁离子,然后结合OH-生成Fe(OH)2沉淀,最终被氧化生成氢氧化铁沉淀。
(2))打开K1,闭合K2,装置是电解池F是阳极,E是阴极,阳极氯离子放电,生成氯气,可利用氯气的氧化性来检验。
(3)在(1)中A是正极,有OH-生成,在(2)中阴极有OH-生成,即这两极溶液显红色。因为B极附近生成铁离子,所以溶液会变成蓝色。而在操作(2)铁作阴极不溶解,过不可能变蓝色。
(4)正极氧气得到电子,而电解质是熔融碳酸盐,导电离子是CO32-,所以正极反应的方程式为2CO2+O2+4e-=2CO32-。在反应中甲烷失去8个电子,因为电池能量转化率为75%,所以11.2L的甲烷实际失去电子为4mol×0.75=3.0mol,依据电子得失守恒可知生成氢气1.5mol。
本题难度:一般
4、填空题 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:① X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。?
请回答:
(1)Z2Y的化学式是?。?
(2)Z2Y2与X2Y反应的化学方程式是?。
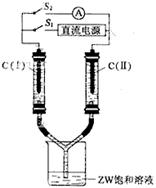
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。?一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是?(填写正极或负极);
C(II)的电极反应式是??。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是?。
参考答案:(1)Na2O? (2)2Na2O2+2H2O=4NaOH+O2↑ (3)负极,Cl2+2e-=2Cl-?(4)Cu + H2O2 + 2H+= Cu2++2H2O
本题解析:中学阶段A2B2型的化合物主要指Na2O2和 H2O2,共价化合物是H2O2,离子化合物是Na2O2,所以根据X、Y、Z、W的原子序数大小顺序课判断X是H,Y是O,Z是Na,W是Cl。
(1)Z2Y的化学式是Na2O。?
(2)Z2Y2与X2Y反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑。
(3)根据装置图可知,接通S1后该装置是电解池,即相当于是惰性电极电解饱和氯化钠溶液。C(Ⅰ)附近溶液变红,说明该电极是阴极,生成的气体是氢气,另外一电极生成的是氯气。断开S1,接通S2,电流表的指针发生偏转,说明此时形成原电池,其中氢气所在的电极是负极,即C(I)的电极名称是负极。C(II)的电极是正极,氯气得到电子,电极反应式是Cl2+2e-=2Cl- 。
(4)双氧水具有氧化性,钠氧化单质铜,则反应的离子方程式是Cu + H2O2 + 2H+= Cu2++2H2O。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,主要是考查学生对常见化合物以及电化学原理的熟悉了解程度,有利于调动学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是记住常见的化合物,明确原电池和电解池的工作原理,然后结合题意灵活运用即可。
本题难度:一般
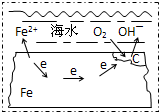
5、选择题 图表示的是钢铁在海水中的锈蚀过程,以下有关说法正确的是( )
A.该金属腐蚀过程为吸氢腐蚀
B.正极为C,发生的反应为氧化反应
C.在酸性条件下发生的是吸氧腐蚀
D.正极反应为:O2+2H2O+4e→4OH-