1、填空题 (1)2008年9月25日,“神舟七号”载人航天飞船在酒泉卫星发射中心成功发射升空。航天飞船曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
(1)写出其中涉及的化学方程式:_____________;____________。
(2)高氯酸铵作为火箭燃料的重要供氧剂。高氯酸铵在高压、450 ℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式:____________________。
②反应中生成的氧化产物与还原产物的物质的量之比是__________,每分解1 mol高氯酸铵,转移的电子数目是__________。
参考答案:(1)4Al+3O2 2Al2O32NH4ClO4
2Al2O32NH4ClO4 N2↑+4H2O↑+Cl2↑+2O2↑
N2↑+4H2O↑+Cl2↑+2O2↑
(2)①4NH4ClO4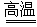 6H2O↑+2N2↑+4HCl↑+5O2↑
6H2O↑+2N2↑+4HCl↑+5O2↑
②7∶48NA或8×6.02×1023
本题解析:(1)铝粉在加热被氧化时放出大量热量使高氯酸铵分解,结合题给信息产物为N2、H2O、Cl2、O2。由元素守恒可知方程式为2NH4ClO4 N2↑+4H2O↑+Cl2↑+2O2↑。
N2↑+4H2O↑+Cl2↑+2O2↑。
(2)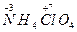 在高压、450 ℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气,其中N、O被氧化,Cl元素被还原。由电子守恒可知方程式为4NH4ClO4
在高压、450 ℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气,其中N、O被氧化,Cl元素被还原。由电子守恒可知方程式为4NH4ClO4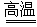 6H2O↑+2N2↑+4HCl↑+5O2↑,氧化产物N2、O2与还原产物HCl的物质的量之比=(2+5)∶4=7∶4;每分解1 mol高氯酸铵,转移的电子数目是8NA。
6H2O↑+2N2↑+4HCl↑+5O2↑,氧化产物N2、O2与还原产物HCl的物质的量之比=(2+5)∶4=7∶4;每分解1 mol高氯酸铵,转移的电子数目是8NA。
本题难度:简单
2、填空题 食品安全是社会关注的热点。市场上已检测出一些矿泉水中含有高浓度的致癌物“溴酸盐”,而这个“行业秘密”在人们的眼皮底下被隐藏了10多年。实验室中制备“溴酸盐”过程如下:
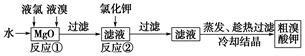
根据上述转化关系回答下列问题:
(1)反应①的化学方程式为______________________________。
(2)已知反应②是复分解反应,该反应的化学方程式为_____________________________。
(3)已知在酸性条件下溴酸盐可发生如下离子反应:
Ⅰ.2BrO3-+10Cl-+12H+=5Cl2↑+Br2+6H2O
Ⅱ.6BrO3-+5Cl-+6H+=5ClO3-+3Br2+3H2O
Ⅲ.BrO3-+5Br-+6H+=3Br2+3H2O
①上述反应所涉及的粒子中,氧化性最强的是________。
②在KCl和KBr的酸性混合溶液中,加入过量的KBrO3,其氧化产物为________,还原产物为________。
③将12 mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.6 mol·L-1 KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为________。
参考答案:(1)6MgO+Br2+5Cl2=Mg(BrO3)2+5MgCl2
(2)Mg(BrO3)2+2KCl=MgCl2↓+2KBrO3
(3)①BrO3- ②KClO3、Br2 Br2 ③3∶1
本题解析:分析实验过程,由于反应②中只加入KCl,不会发生氧化还原反应,反推知反应①中必生成BrO3-,由此得反应①中的化学方程式为6MgO+Br2+5Cl2=Mg(BrO3)2+5MgCl2,第一次过滤掉的滤渣是MgO。经过反应②又过滤,那原因是什么呢?考虑到加入KCl发生的是复分解反应,反应发生的原因显然是利用MgCl2溶解度小的特点,反应的化学方程式为Mg(BrO3)2+2KCl=MgCl2↓+2KBrO3,第二次过滤掉的滤渣是MgCl2,然后进行系列实验操作即可得KBrO3晶体。(3)在三个反应中BrO3-均作氧化剂,所以氧化性其最强。对比反应Ⅰ和Ⅱ,可知KBrO3过量时,Cl-被氧化成ClO3-,还原产物为Br2,反应Ⅲ中Br2既是氧化产物也是还原产物。③由题可知KBrO3的物质的量为4.8×10-3 mol,KCl的物质的量为6×10-3 mol,两者物质的量之比为4∶5。设参加反应Ⅰ的KBrO3的物质的量为x,则参加反应Ⅱ的KBrO3的物质的量为
(4-x),由Cl-守恒得:5x+ (4-x)=5,得x=
(4-x)=5,得x=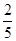 ,反应Ⅰ生成的氯气为1,反应Ⅱ生成的KClO3为3。
,反应Ⅰ生成的氯气为1,反应Ⅱ生成的KClO3为3。
本题难度:一般
3、填空题 (10分)实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为:
2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
(1)请将上述化学方程式改写为离子方程式________________。
(2)浓盐酸在反应中显示出来的性质是________________(填写编号,多选倒扣)。
①只有还原性?②还原性和酸性
③只有氧化性?④氧化性和酸性
(3)此反应中氧化产物是?(填化学式),产生0.5molCl2,则转移的电子的物质的量为______mol。
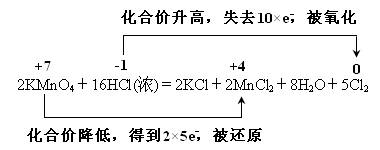
(4).用双线桥法表示该反应的电子转移的方向和数目
参考答案:(1)2MnO4—+16H++10Cl—===2Mn2++5Cl2↑+8H2O(2分)
(2)②(2分)
(3) Cl2(2分)? 1 (2分)(4)略(2分)
本题解析:(1)离子方程式为:2MnO4—+16H++10Cl—===2Mn2++5Cl2↑+8H2O;
(2)HCL在反应中CL元素的化合价部分升高即总分被氧化,部分不变作用酸性;
(3)在氧化还原反应中还原剂生成氧化产物,即为Cl2,产生0.5molCl2,则转移的电子的物质的量为1mol。
(4)
本题难度:一般
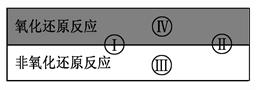
4、填空题 氧化还原反应在生产、生活中具有广泛用途,贯穿古今。
(1)下列生产、生活中的事例中有发生氧化还原反应的是?。(有两个正确选项)
A.古代活字印刷
B.原电池工作
C.简单机械织布
D.我国古代湿法炼铜