1、简答题 8.4g单质A能从足量的盐酸中置换出3.36L(标准状况下)的H2,同时生成ACl2;另一种元素B的最高价氧化物的化学式为BO3.在B的氢化物中,B的质量分数为94.1%.
(1)计算A、B两种元素的相对原子质量,写出相应的元素符号.______
(2)写出A、B反应的化学方程式,用双线桥标出电子转移情况.______.
参考答案:(1)设A、B的相对原子质量分别为MA、MB,则有:
A+2HCl=ACl2+H2↑
MAg 22.4L
8.4g3.36L
所以MAg:8.4g=22.4L:3.36L,解得MA=56,故A为Fe,
据题意可知,B的氢化物的化学式为H2B,故有2:MB=(1-94.1%):94.1%,解得MB≈32,故B为S,
故答案为:56,Fe;32,S;
(2)Fe与S发生反应Fe+S△.FeS,转移电子数目为2,用双线桥标出电子转移为: ,
,
故答案为: .
.
本题解析:
本题难度:一般
2、选择题 在SO2+2H2S = 2H2O+3S ↓ 反应中,氧化产物与还原产物的物质的量之比为
A.2∶1 B.1∶2 C .3∶1
.3∶1  D.1∶3
D.1∶3
参考答案:A
本题解析:略
本题难度:一般
3、选择题 下列化学用语正确的是(?)
A.CaH2的电子式:[H:]_Ca2+[:H]-
B.铝离子的结构示意图:
C.CO2的比例模型:
D.核内有8个中子的碳原子: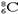
参考答案:A
本题解析:B、铝离子的结构示意图: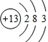 ,错误;C、碳原子比氧原子的半径大,错误;D、核内有8个中子的碳原子14? 6C,正确。
,错误;C、碳原子比氧原子的半径大,错误;D、核内有8个中子的碳原子14? 6C,正确。
本题难度:一般
4、填空题 (16分)海水中含有非常丰富的化学资,从海水中可提取多种化工原料。下图是某工厂对海水资综合利用的示意图。
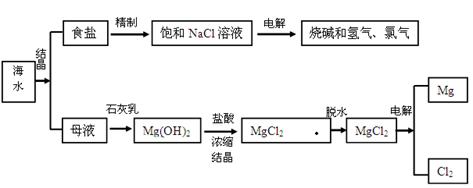
试回答下列问题:
(1)我国政府规定食用盐中必须加入一定量的KIO3(碘酸钾),其中碘元素的化合价为 价。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,方法是将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液;⑤加过量的氯化钡溶液,合理的操作顺序是 ①③(填序号)。
(3)写出电解饱和食盐水的化学方程式 ,当转移0.2mol电子时,阴阳两极生成的气体体积之和是 (标准状况下)。
(4)以海边贝壳为原料可以制取石灰乳,贝壳的主要化学成分为 (写化学式)。
(5)目前,世界上生产的镁有60%自海水,由“母液”制“镁”的过程中,发生了 个复分解反应(填数目)。
(6)电解氯化镁所得的氯气,除用于生产盐酸外,还可以用于制取漂白粉,漂白粉的有效成份
是 (写化学式)。
(7)溴主要以Br-形式存在于海水中,提取食盐后剩下的母液(也叫卤水)中,Br-的浓度较大,工业上 制备的Br2的操作步骤为:一定条件下,将Cl2通入卤水中,生成Br2,利用热空气将Br2吹出,Br2可用热空气吹出,其原因是 。
参考答案:(1)+5 (2)⑤④②或②⑤④或⑤②④
(3)2 NaCl + 2H2O Cl2↑+ 2NaOH + H2↑ 4.48L
Cl2↑+ 2NaOH + H2↑ 4.48L
(4)CaCO3 (5)2 (6)Ca(ClO)2 (7)Br2具有挥发性
本题解析:(1)在碘酸钾中,钾为+1,氧为-2,所以碘为+5。(2)除去粗盐中的杂质,用氢氧化钠除去镁离子,碳酸钠除去钙离子,氯化钡除去硫酸根离子,为了保证杂质完全除去,所加的除杂试剂是过量的,所以为了不引入新的杂质,需要将氯化钡放在碳酸钠试剂前,用碳酸钠除去剩余的钡离子,除掉相关杂质后,将沉淀过滤,再加入适量的盐酸除去多余的碳酸钠和氢氧化钠,所以合理的操作顺序为:⑤④②①③或②⑤④①③或⑤②④①③。(3)电解食盐水生成氢氧化钠和氯气和氢气,当有0.2摩尔电子转移时,生成氯气和氢气各0.1摩尔,即在标准状况下体积为4.48L。(4)贝壳的主要成分为碳酸钙。(5)从母液制取镁的过程中,加入石灰乳的反应为氯化镁和氢氧化钙生成氢氧化镁沉淀和氯化钙,属于复分解反应,氢氧化镁与盐酸的反应属于复分解反应,氯化镁电解成镁和氯气,属于分解反应,故复分解反应有2个。(6)漂白粉的有效成分是次氯酸钙。(7)单质溴有挥发性,所以可以用热空气吹出。
考点:海水的综合利用。
本题难度:一般
5、填空题 (2分)钠原子的质量数为23,中子数为12,那么它的核外电子数是__________,质子数是__________。
参考答案:11? 11
本题解析:根据质量数=质子数+中子数及核外电子数=质子数知质子数、电子数均为11.
本题难度:简单