|
高考化学知识点整理《热化学方程式》高频考点预测(2020年最新版)(二)
2021-02-18 06:36:49
【 大 中 小】
|
1、计算题 氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。
反应①②③为_________反应(填“吸热”或“放热”)。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为__________________。
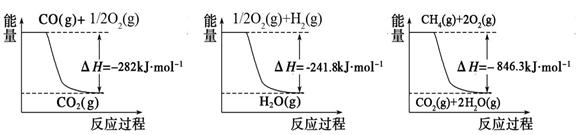
① ② ③
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。 CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10L的密闭容器中通入2mol NH3和1molCO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=___________。该温度下平衡常数K的计算结果为____________。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是_____________
A.提高NH3的浓度
B.增大压强
C.及时转移生成的尿素
D.使用更高效的催化剂
|
参考答案:(16分)(1)放热(2分) CH4(g)+H2O(g)=CO(g)+3H2 (g) ΔH=+161.1kJ?mol-1(4分)
(化学方程式书写占2分,未配平不给分,未标注状态得1分;反应热计算占2分,漏“+”且数值正确,得1分)
(2)①K=c(H2O)/[c(CO2) ? c2(NH3)](3分)100 L2?mol-2(3分,未写单位不扣分)
②AB(4分。漏选得2分;多选一个扣2分,扣完4分为止)
本题解析:(1)读图可知,①②③的反应物能量都高于生成物能量,所以三个反应都是放热反应;已知:①CO(g)+1/2O2(g)=CO2(g) △H1=-282kJ?mol-1,②1/2O2(g)+ H2(g)=H2O(g) △H2=-241.8kJ?mol-1,③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-846.3kJ?mol-1,观察可知,③—②×3—①能够约去2O2(g)、CO2(g),根据盖斯定律可以得到的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2 (g) ΔH=+161.1kJ?mol-1;(2)①已知可逆反应中氨气、二氧化碳、水都是气体,而尿素是纯液体,纯液体或固体物质不写入化学平衡常数表达式,由平衡常数定义式可得:K=c(H2O)/[ c2(NH3) ?c(CO2)];根据三行浓度法,则:
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) CO(NH2)2(l)+H2O(g)
起始浓度/ mol?L-1 0.2 0.1 0
变化浓度/ mol?L-1 0.1 0.05 0.05
平衡浓度/ mol?L-1 0.1 0.05 0.05
K=c(H2O)/[ c2(NH3) ?c(CO2)]=0.05mol?L-1÷(0.1mol?L-1)2÷(0.05mol?L-1)=100L2?mol-2
②提高氨气的浓度,增大一种反应物浓度,平衡右移,则另一种反应物的转化率增大,所以二氧化碳的平衡转化率增大,故A正确;制取尿素是气态物质体积减小的反应,增大压强平衡右移,则反应物的转化率均增大,故B正确;尿素是纯液体,及时转移生成的尿素,不能减小尿素的浓度,则平衡不移动,所以二氧化碳的平衡转化率不变,故C错误;催化剂只能改变反应速率,不能使平衡移动,则反应物的转化率不变,故D错误。
考点:考查反应热、热化学方程式、盖斯定律、化学平衡常数及其计算、外界条件对化学平衡的影响。
本题难度:困难
2、填空题 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) 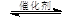 CH3OCH3(g) + 3H2O(g) CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[n(H2) / n(CO2)]
| 500 K
| 600 K
| 700 K
| 800 K
| 1.5
| 45%
| 33%
| 20%
| 12%
| 2.0
| 60%
| 43%
| 28%
| 15%
| 3.0
| 83%
| 62%
| 37%
| 22%
|
①若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比[n(H2) / n(CO2)],则K将 。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式
。若通入甲醚(沸点为-24.9 ℃)的速率为1.12 L·min-1(标准状况),并以该电池作为电源电解2 mol·L-1 CuSO4溶液500 mL,则通电30 s后理论上在阴极可析出金属铜 g。
参考答案:(12分)(1)CH4(g) +2NO2(g)=N2(g) +CO2(g) +2H2O(g) △H=-867 kJ·mol-1(3分)
(2)①减小(2分) 不变(2分) ②CH3OCH3 -12e- +16OH-=2CO32- +11H2O(3分) ③9.6(2分)
本题解析:(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的。则两式相加,可得反应2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g),所以反应热△H=-574 kJ/mol--1160 kJ/mol=-1734 kJ/mol 。
(2)①根据表中数据可知,随着温度的升高,CO2的转化率是减小的,这说明升高温度平衡向逆反应方向移动,所以正方应是放热反应。升高温度平衡常数减小。温度不变,提高投料比[n(H2) / n(CO2)],CO2的转化率增大。但平衡常数只与温度有关系,因此平衡常数是不变的。
②原电池中负极失去电子,所以甲醚在负极通入。由于电解质是碱性的,则负极的电极反应式是CH3OCH3 -12e- +16OH-=2CO32- +11H2O。通电30s后成反应的甲醚是1.12 L·min-1×0.5min=0.56L,物质的量是0.56L÷22.4L/mol=0.025mol,因此根据电极反应式可知转移电子的物质的量是0.025mol×12=0.3mol。阴极是铜离子得到电子,电极反应式是Cu2++2e-=Cu,所以生成的铜是0.3mol÷2=0.15mol,质量是0.15mol×64g/mol=9.6g。
考点:考查盖斯定律的应用、外界条件对平衡状态以及平衡常数的影响、电化学原理的应用和计算
点评:该题是中等难度的试题,也是高考中的常见题型。试题贴近高考,难易适中,基础性强,有利于调动学生的学习兴趣和学习积极性,提高学生的应试能力和学习效率。也有利于培养学生的逻辑推理能力和抽象思维能力。
本题难度:困难
3、填空题 (14分)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) △H=—566kJ?moL-1
2H2(g)+O2(g)=2H2O(g) △H=—483.6kJ?moL-1
H2O(g)=H2O(l) △H=—44.0kJ?moL-1
(1)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:___________________________。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=—92.4kJ/mol 2NH3(g) △H=—92.4kJ/mol
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。
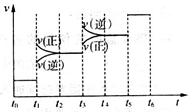
①图中t3时引起平衡移动的条件可能是__________________________________________,其中表示平衡混合物中NH3的含量最高的一段时间是_____________。
②温度为T℃时,将1 mol N2和2 mol H2放入容积为0.5 L的密闭容器中,充分反应后测得N2的平衡转化率为50%。则反应在T℃时的平衡常数为____________mol-2·L2。
③目前工业合成氨的原理是:
下图表示随条件改变,平衡体系中氨气体积分数的变化趋势。
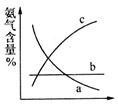
当横坐标为压强时,变化趋势正确的是(填序号,下同)__________,当横坐标为温度时,变化趋势正确的是___________。
(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为_______>_______>_______>________。
参考答案:(每空2分,共14分)(1)CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
(2)①升温 t2-t3 ②4 ③c a
(3)c(Cl-)>c(NH4+)>c(H+)>c(OH-) (顺序正确得2分,顺序有误不得分)
本题解析:(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=—566kJ?moL-1,②2H2(g)+O2(g)=2H2O(g)△H=—483.6kJ?moL-1,则根据盖斯定律可知(①—②)÷2即可得到CO和H2O(g)作用生成CO2和H2的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2kJ·mol-1。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=—92.4kJ/mol 2NH3(g) △H=—92.4kJ/mol
①t3时正逆反应速率均增大,其中逆反应速率大于正反应速率,平衡向逆反应方向进行。由于正方应是体积减小的放热的可逆反应,则引起平衡移动的条件是升高温度。平衡向正反应方向进行,氨气的含量高,因此根据图像可知表示平衡混合物中NH3的含量最高的一段时间是t2-t3。
②温度为T℃时,将1 mol N2和2 mol H2放入容积为0.5 L的密闭容器中,充分反应后测得N2的平衡转化率为50%。则根据方程式可知生成氨气是0.5mol×2=1.0mol,剩余氨气0.5mol,氢气2mol—1.5mol=0.5mol,则反应在T℃时的平衡常数为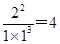 mol-2·L2。 mol-2·L2。
③目前工业合成氨的原理是: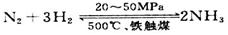
图表示随条件改变,平衡体系中氨气体积分数的变化趋势。当横坐标为压强时,增大压强平衡向正反应方向进行,氨气的含量升高,所以变化趋势正确的是c;当横坐标为温度时,升高温度平衡向逆反应方向进行,氨气的含量降低,则变化趋势正确的是a。
(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,二者恰好反应生成氯化铵,铵根水解溶液显酸性,则所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为c(Cl-)>c(NH4+)>c(H+)>c(OH-) 。
考点:考查盖斯定律、外界条件对平衡状态的影响、平衡常数计算以及浓度大小比较
本题难度:困难
4、填空题 饮用水中含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3-的浓度,某兴趣小组提出如下方案:
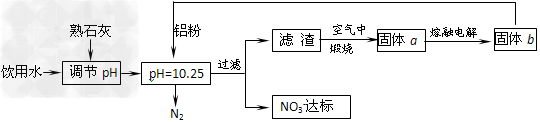
请回答下列问题:
⑴已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3-反应的离子方程式为__________________________________________。
⑵该方案中选用熟石灰调节pH,理由是_______________________、__________________,在调节pH时,若pH过大或过小都会造成____________的利用率降低。
⑶用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为____________________________________。
⑷饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
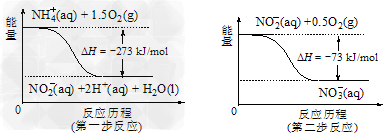
试写出1?mol?NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是____________________。
参考答案:⑴10Al+6NO3-+18H2O==10Al(OH)3+3N2↑+6OH-
⑵引入的Ca2+对人体无害;来源丰富、价格便宜;铝
⑶5H2+2NO3-?==N2+4H2O+2OH-
⑷NH4+(aq)+2O2(g)==2H+(aq)+NO3-(aq)+H2O(l)?△H?=-346?kJ/mol
本题解析:
本题难度:一般
5、填空题 发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。已知:
? 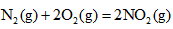 △H=+67.7kJ·mol-1 △H=+67.7kJ·mol-1
?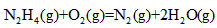 △H=-543kJ·mol-1 △H=-543kJ·mol-1
? △H=-269kJ·mol-1 △H=-269kJ·mol-1
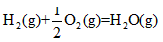 ?△H=-242kJ·mol-1 ?△H=-242kJ·mol-1
(1)肼和反应的热化学方程式为:______________ 。
(2)有人认为若用氟气代替作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式为:______________ 。
参考答案:(1)2N2H4(g) + 2NO2(g) == 3N2(g) + 4H2O(g) ΔH = -1153.7 kJ·mol-1
(2)N2H4(g) + 2F2(g) == N2(g) + 4HF(g) ΔH = -1135 kJ·mol-1
本题解析:
本题难度:一般
|