1、简答题 用右图所示装置进行实验,将A逐滴加入B中;
(1)若A为浓硫酸,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,则B是______(写化学式),B与浓H2SO4反应的化学方程式为______;反应后往烧杯中加入沸水,又可观察到试管C中的现象为______.
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是______.然后往烧杯中加入沸水,可观察到试管C中的现象是______.
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是______(写名称),C是______(写化学式)与葡萄糖的混合液.该反应的离子方程式为______,仪器D在此实验中的作用是______.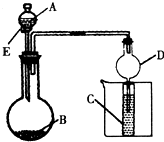
参考答案:(1)由题意可知,B为第三周期金属元素的片状单质,其在常温下难与水反应,B可能为铝活着镁,但浓硫酸常温下会使铝钝化,所以B只能为镁,与浓硫酸发生氧化还原反应,反应的方程式为Mg+2H2SO4(浓)=MgSO4+SO2↑+2H2O,SO2具有漂白性,可使品红褪色,但不稳定,加热又能恢复到原来的颜色,
故答案为:Mg;Mg+2H2SO4(浓)=MgSO4+SO2↑+2H2O;C中溶液变红;
(2)观察到小试管内溶液变浑浊,说明生成二氧化碳,则A的酸性应比碳酸的酸性强,生成苯酚易溶于热水,加热溶液变澄清,
故答案为:酸性比碳酸的酸性强;溶液由浑浊变澄清;
(3)试管壁出现光亮的银镜,说明生成氨气,可用浓氨水或铵盐的浓溶液与生石灰反应制取,C中应为葡萄糖与银氨溶液的反应,则C中应为AgNO3和葡萄糖的混合液,加热时发生:CH2OH(CHOH)4CHO+2[Ag(NH3)2]++2OH-水溶
本题解析:
本题难度:一般
2、填空题 中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体.(图中部分产物和反应条件已略去)
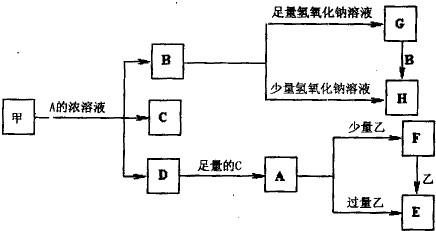
回答下列问题:
(1)写出甲与A的浓溶液反应的化学方程式______.
(2)将等体积等浓度的G溶液和H溶液混合后得到的溶液中的离子浓度大小关系为______.
(3)除去G固体中含有H杂质采用的方法是______.
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝色的气体反应,生成一种盐,该盐的溶液呈酸性,其原因是(用离子方程式表示)______.
(5)写出向E溶液中加入少量稀硫酸后反应的离子方程式______.将溶液F加热蒸干、灼烧到质量不再减少时所得固体物质的化学式为______.
(6)确定E中阳离子实验的方法为______.
参考答案:D是红棕色气体,说明D是二氧化氮;甲是黑色非金属单质,且和A的浓溶液反应生成二氧化氮,说明甲是碳,A溶液是浓硝酸,则B是二氧化碳,C是水;二氧化碳和足量氢氧化钠溶液反应生成碳酸钠和水,而二氧化碳和少量氢氧化钠溶液反应生成碳酸氢钠和水,所以G是碳酸钠,而H是碳酸氢钠;二氧化氮和水反应生成硝酸;由硝酸和少量乙反应生成F,和过量乙反应生成E,F和乙又可生成E,可知乙为金属铁,而F为硝酸铁,E为硝酸亚铁,
(1)D是红棕色气体,说明D是二氧化氮;由甲是黑色非金属单质,且和A的浓溶液反应生成二氧化氮,说明甲是碳,A溶液是浓硝酸,则B是二氧化碳,C是水,反应的化学方程式为:C+4HNO3(浓)?△?.??CO2↑+4NO2↑+2H2O;故答案为:C+4HNO3(浓)?△?.??CO2↑+4NO2↑+2H2O;
(2)碳酸钠和碳酸氢钠的混合液中,碳酸根的水解程度大于碳酸氢根的水解程度,溶液显示碱性,离子浓度大小关系是:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)碳酸氢钠受热分解为碳酸钠、水以及二氧化碳,而碳酸钠受热稳定,可以用加热法除去碳酸钠中的碳酸氢钠,故答案为:加热;
(4)能使湿润的红色石蕊试纸变蓝色的气体反应是氨气,硝酸和氨气反应生成硝酸铵,由于铵根水解导致溶液显示酸性,故答案为:NH4++H2O

NH3?H2O+H+;
(5)向硝酸亚铁中加入硫酸,相等于存在硝酸,硝酸可以将亚铁离子氧化,实质是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,硝酸亚铁易被氧气氧化为硝酸铁,三价铁水解生成氢氧化铁,受热分解为氧化铁,故答案为:3Fe2++NO3-+4H+=3?Fe3++NO↑+2H2O;Fe2O3;
(6)亚铁离子易被氧化为三价铁,三价铁遇到硫氰酸钾显示红色,亚铁离子的检验方法:先加入KSCN溶液无变化再加入氯水(或盐酸等)溶液变红色,故答案为:先加入KSCN溶液无变化,再加入氯水(或盐酸等)溶液变红色.
本题解析:
本题难度:简单
3、填空题 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。

请回答:(1)若A为金属单质,B、C为非金属单质,且常温下B、C均为无色气体,D为黑色固体,则B的化学式为?,A与E在一定条件下反应生成D的化学方程式为
?。
(2)若A为非金属单质,且常温下为黄绿色气体,B为金属单质,C为酸,且C的组成中含有与A相同的元素。则构成非金属单质A的元素原子结构示意图为?, A与E在一定条件下反应生成D的离子方程式为?。
参考答案:

本题解析:略
本题难度:一般
4、简答题 X、Y是中学化学里常用的物质,其中Y是单质,X是化合物;它们之间相互反应以及生成物之间的关系如图所示:
已知E溶液跟NH4SCN的稀溶液混合时,溶液呈血红色.请回答:
(1)Y和X浓溶液反应的条件是______,而常温下难反应的原因是______.
(2)写出F和G相互转化的化学方程式:F→G+X______G→F______
(3)L转化成I的现象是______,有关的化学方程式是______.
参考答案:X、Y是中学化学里常用的物质,其中Y是单质,X是化合物;它们之间相互反应以及生成物之间的关系如图所示:已知E溶液跟NH4SCN的稀溶液混合时,溶液呈血红色,说明E含有Fe3+离子,加入氢氧化钠溶液生成氢氧化铁沉淀I为Fe(OH)3,L为Fe(OH)2,H为含Fe2+离子的溶液;K为推断Y为Fe,D为H2O,J为O2,依据Y和X的浓溶液反应生成的F和D反应生成G和X,判断F为NO2,X为HNO3,G为NO,所以推断出E为Fe(NO3)3,H为Fe(NO3)2,依据推断得到的物质分别为:X为HNO3,Y为Fe;D为H2O,Fe(NO3)3,H为Fe(NO3)2,F为NO2,G为NO,J为O2,K为NaNO3,L为
Fe(OH)2,I为Fe(OH)3;
(1)Y和X浓溶液反应的条件是加热,常温下铁在浓硝酸中 发生钝化现象;
故答案为:加热,Fe表面被浓硝酸钝化;
(2)依据分析推断得到F→G+X反应的化学方程式为:3NO2+H2O=2HNO3+NO,G→F反应的化学方程式为:2NO+O2=2NO2
故答案为:3NO2+H2O=2HNO3+NO,2NO+O2=2NO2
(3)L转化成I是氢氧化亚铁被一氧化为氢氧化铁,反应的现象是:白色固体迅速变为灰绿色,最后变为红褐色,有关的化学方程式是?4Fe(OH)2+2H2O+O2=4Fe(OH)3;
故答案为:白色固体迅速变为灰绿色,最后变为红褐色; 4Fe(OH)2+2H2O+O2=4Fe(OH)3;
本题解析:
本题难度:一般
5、推断题 用惰性电极电解A的溶液,在一定条件下,B、C、D、E、 ?F有如图反应关系(部分反应物或生成物略),E随意排放造成对大气的污染,往A的溶液中慢慢滴入一种溶质为短周期元素组成的溶液先产生沉淀,继续滴加沉淀溶解,所得溶液在一定条件下与一种营养物质反应,析出一种单质。
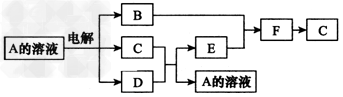
请回答下列问题: ?
(1)写出下列物质的化学式:A:__________,F:___________。 ?
(2)电解400?mL?0.10?mol/L?A的溶液时,阳极电极反应式为_________________。若阴极产生0.?224?L(标准状况下)的气体后,要恢复到电解前的状态(溶液的质量和浓度),则需要加入的物质的质量为__________g。 ?
(3)将0.22?mol?E和0.10?mol?B放入容积为1L的密闭容器中,在一定条件下发生可逆反应2E(g)+B(g)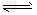 2F(g),在一定温度下,反应达到平衡,得到0.?10?mol?F,则反应的平衡常数K的值为____;若温度不变,再加入0.?45?mol?B和0.?01?mol?F,此时v(正)____(填“>”、“=”或“<”)v(逆);重新达到平衡后,E的转化率____(填“增大”“不变”或“减小”),F的体积分数____(填“增大”、“不变”或“减小”)。
2F(g),在一定温度下,反应达到平衡,得到0.?10?mol?F,则反应的平衡常数K的值为____;若温度不变,再加入0.?45?mol?B和0.?01?mol?F,此时v(正)____(填“>”、“=”或“<”)v(逆);重新达到平衡后,E的转化率____(填“增大”“不变”或“减小”),F的体积分数____(填“增大”、“不变”或“减小”)。
参考答案:(1)AgNO3;NO2
(2)4OH--4e-=2H2O+O2↑;4.82
(3)13.?9;>;增大;减小
本题解析:
本题难度:一般