1、选择题 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )
A.放电时负极反应为:Zn-2e-+2OH-Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-FeO42-+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
参考答案:A、根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,故A正确;
B、充电时阳极发生Fe(OH)3失电子的氧化反应,即反应为:Fe(OH)3-3e-+5OH-?充电?.?FeO42-+4H2O,故B正确;
C、放电时正极反应为FeO42+4H2O+3e-=Fe(OH)3+5OH-,每转移3mol电子,正极有1molK2FeO4被还原,故C错误;
D、放电时正极反应为FeO42+4H2O+3e-=Fe(OH)3+5OH-,生成氢氧根离子,碱性要增强,故D正确.
故选C.
本题解析:
本题难度:一般
2、选择题 氢氧燃料电池已用于航天飞机,它是以铂作电极,KOH溶液作电解质,下列叙述不正确的是
[? ]
A.H2在负极发生氧化反应
B.燃料电池的能量转化率可达100%
C.产物为无污染的水,属于环境友好电池
D.供电时的总反应为:2H2+ O2= 2H2O
参考答案:B
本题解析:
本题难度:一般
3、选择题 下图是日常生活中常见电动自行车主要部件之铅蓄电池结构示意图,有关说法不正确的是
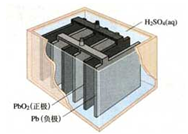
A.铅蓄电池属于二次电池
B.实际使用过程中可以无限次充放电
C.使用过程中负极发生氧化反应
D.铅蓄电池体积大有污染还不是最理想的电池
参考答案:B
本题解析:铅蓄电池可重复充放电,属于二次电池,也就是充电电池;放电时,做为原电池,负极发生氧化反应;由于可能造成重金属铅的污染,所以不是最理想的电池;
随着充电次数的增多,电池的容量减小、电池的内阻增大,电池的性能越来越差,故选项B符合题意
本题难度:一般
4、选择题 镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点.其中一种镁原电池的反应为:x?Mg+Mo3S4?
MgxMo3S4.在镁原电池放电时,下列说法错误的是( )
A.Mo3S4发生氧化反应
B.正极反应为:Mo3S4+2xe-=Mo3S42x-
C.Mg2+向正极迁移
D.负极反应为:xMg-2xe-=xMg2+
参考答案:A、放电是原电池反应,负极反应是镁失电子发生氧化反应,正极反应物质是Mo3S4,得到电子发生还原反应,故A错误;
B、正极反应物质是Mo3S4,得到电子发生还原反应,正极电极反应为:Mo3S4+2xe-=Mo3S42x-,故B正确;
C、负极生成镁离子,Mg2+向正极迁移,故C正确;
D、负极反应是镁失电子发生氧化反应;负极电极反应为:xMg-2xe-=xMg2+,故D正确;
故选A.
本题解析:
本题难度:简单
5、填空题 (10分)设计出燃料电池使天然气CH4氧化直接产生电流是对世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入天然气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。回答如下问题:
(1)这个电池的正极发生的反应是:?;(2分)
(2)负极发生的反应是:?;(2分)
(3)固体电解质里的O2-的移动方向是:?;(2分)
(4)天然气燃料电池最大的障碍是氧化反应不完全,产生?堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间,正是新一代化学家的历史使命。(2分)
(5)若将此甲烷燃料电池设计成在25%的KOH溶液中的电极反应,该电池的负极区域的碱性会__________(填“增强”、“减弱”或“不变”)。(2分)
参考答案:(1)O2+4e-=2O2-(2分)?(2)CH4-8e-=CO2+2H2O(2分)
(3)正极流向负极(2分)?(4)碳(2分)?(5)减弱(2分)
本题解析:(1)原电池中正极得到电子,所以氧气在正极通入。又因为电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子,所以正极电极反应式为O2+4e-=2O2-。
(2)负极失去电子,因此甲烷在负极通入,甲烷的氧化产物是CO2和水,所以电极反应式为CH4-8e-=CO2+2H2O。
(3)原电池中,负极失去电子,所以阴离子流向负极。
(4)甲烷不完全反应,可能产生碳单质堵塞电极的气体通道。
(5)如果电解质是氢氧化钠,则负极电极反应式为H2-2e-+2OH-=2H2O,所以负极周围溶液的碱性减弱。
本题难度:一般