1、计算题 为了测定某铜银合金铁成分,将30.0 g合金完全溶于80 mL 13.5 mol·L-1的浓HNO3中,待合金完全溶解后,收集到6.72 L(标准状况)气体,并测得溶液的c(H+)="1" mol·L-1。假设反应后溶液的体积仍为80 mL,试计算:
(1)被还原的硝酸的物质的量;
(2)合金中银的质量分数。
参考答案:(1)0.3 mol? (2)36%
本题解析:(1)由于HNO3的还原产物为NO或NO2或二者的混合物,根据N原子守恒:则被还原的HNO3的物质的量等于气体的物质的量:
n(HNO3)=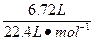 ="0.3" mol
="0.3" mol
(2)设合金中银的质量为x,则
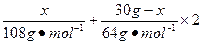 =13.5mol·L-1×0.08L-1mol·L-1×0.08L-0.3mol
=13.5mol·L-1×0.08L-1mol·L-1×0.08L-0.3mol
x="10.8" g
银的质量分数:
w(Ag)= ×100%=36%
×100%=36%
本题难度:简单
2、选择题 把一小块金属钠投入到浓氨水中,逸出的气体为(?)
A.全为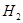
B.全为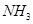
C.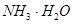
D.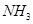 和
和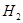
参考答案:D
本题解析:钠溶于水生成氢氧化钠和氢气,生成的氢氧化钠是强碱,且反应放出热量,所以会加速氨水的分解生成氨气,答案选D。
点评:该题是基础性试题的考查,主要是考查学生对金属钠化学性质的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
3、选择题 跟氨分子所含的质子总数和电子总数都相同的粒子是(?)
A.Na+
B.Mg2+
C.HCl
D.HF
参考答案:D
本题解析:Na+、Mg2+、HCl、HF质子总数分别为11、12、18、10;电子总数分别为10、10、18、10。
本题难度:简单
4、选择题 下列气态氢化物最稳定的是
A.HCl
B.HBr
C.HF
D.H2O
参考答案:C
本题解析:略
本题难度:简单
5、填空题 (4分)NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”。请回答下列问题。
(1)NO的危害在于??(填以下项目的编号)
A.破坏臭氧层
B.高温下能使一些金属氧化
C.造成酸雨
D.与人体血红蛋白结合