1、选择题 为鉴别K2CO3和NaHCO3两种白色固体,有五位同学为鉴别它们,分别设计了下列五种不同的方法,其中不可行的是
①分别取样加入1mol/L的盐酸溶液,看有无气泡产生
②分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
③分别取样配成溶液,滴加BaCl2溶液,观察有无白色浑浊
④分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色
⑤分别取样配成溶液,滴加澄清石灰水,观察有无白色浑浊
A.①③⑤
B.②④
C.①⑤
D.③
参考答案:C
本题解析:两种盐都与盐酸反应生成CO2,所以选项①不能鉴别;碳酸氢钠受热易分解,生成CO2气体,所以选项②可以;碳酸钾能和氯化钡反应生成白色沉淀,而碳酸氢钠不能与氯化钡反应,因此选项③可以;钠和钾的焰色反应是不同的,选项④可以;两种盐都能和石灰水反应生成白色沉淀,所以选项⑤不能鉴别,答案选C。
本题难度:一般
2、选择题 下列气态氢化物中最稳定的是(?)
A.HCl
B.HF
C.NH3
D.H2O
参考答案:B
本题解析:在周期表中的位置关系:? VIIA
二? N? O? F?
三? Cl
同周期,由左到右,原子的得电子能力逐渐增强,则气态氢化物的稳定性增强;
同主族,由上到下,原子的得电子能力逐渐减弱,则气态氢化物的稳定性减弱;
所以,气态氢化物的稳定性顺序:NH3<H2O<HF,HF>HCl,故选B
本题难度:一般
3、填空题 X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是___________;Y和X的组成元素相同,Y的化学式是____________;1 mol Z在加热时跟水反应的产物需要用6 mol的氢氧化钠才能完全中和,在一定条件下,Y可以跟非金属单质A反应生成X和Z,单质A是________________________。
参考答案:H2SO3? SO3?磷
本题解析:由X与水反应生成具有还原性酸知X中除氧外的另一元素R有多种可变价态,应为非金属,又X与水反应生成二元酸知,该元素R为ⅣA族或ⅥA族元素,但CO不与水反应,所以短周期的氧化物中符合题意的只有SO2,对应的酸为H2SO3;与SO2的组成元素相同的物质为SO3;由1 mol Z与H2O反应的产物需6 mol NaOH,才能完全中和,说明该水合物为三元酸,Z中除氧外的另一元素是第ⅤA族元素,所以单质A为磷。
本题难度:简单
4、填空题 (第(1)小题每空1分,其余每空2分,共12分)
A、B、C、D四种短周期元素,原子序数依次增大,A、C同主族,C、D同周期,B原子最外层电子数是最内层电子数的3倍。A、B可形成A2B和A2B2两种液态化合物,B、C也可形成C2B和C2B2两种固态化合物。C+具有与氖原子相同核外电子排布。D原子最外层电子数比B原子最外层电子数多一个电子,根据以上条件,判断:
(1)四种元素分别是(写元素符号) A??B??C??D?
(2)用电子式写出A2B化合物的形成过程___; 用电子式写出C2B化合物的形成过程___;
(3)A2B2中加少量MnO2反应的化学方程式________;C2B2与CO2反应的化学方程_____。
参考答案:(1)H ?O ?Na ?Cl?(写名称不得分)
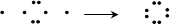 (2)? H? + ?O ?+ ?H? H? O? H ;?
(2)? H? + ?O ?+ ?H? H? O? H ;?
 ?
?

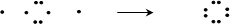 ? Na? +? O? +? Na?
? Na? +? O? +? Na?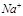 [? O? ]
[? O? ]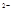
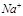 (未标电子转移方向可不扣分)
(未标电子转移方向可不扣分)
MnO2
本题解析:“B原子最外层电子数是最内层电子数的3倍”,则B的核外电子排布为2 6或2 8 6
再结合“A、B可形成A2B和A2B2两种液态化合物,B、C也可形成C2B和C2B2两种固态化合物,C+具有与氖原子相同核外电子排布”,得:A是氢元素、B是氧元素、C是钠元素;D的核外电子排布为2 8 7,所以D为氯元素;
本题难度:简单
5、选择题 下列物质中,属于共价化合物的是
A.NaCl
B.Na2O
C.CaCl2
D.C02
参考答案:D
本题解析:全部由共价键形成的化合物是共价化合物,所以D正确,其余都是离子化合物,答案选D。
考点:考查共价化合物和离子化合物的判断
点评:全部由共价键形成的化合物是共价化合物,而含有离子键的化合物是离子化合物,这说明在离子化合物中可以含有共价键,但在共价化合物不可能存在离子键。
本题难度:一般